
1
Sửa bài tập cuối giờ ngày 28/9/2023
a. Năng lượng cần thiết để ion hóa một nguyên tử Cesi là 3,89 eV.Nếu chiếu một
chùm ánh sáng có bước sóng 5830 Å vào bề mặt kim loại Cesi thì có thể ion hóa
được nguyên tử Cesi hay không? Giải thích. (1 eV = 1,602.10-19 J).
Kiến thức liên quan câu a
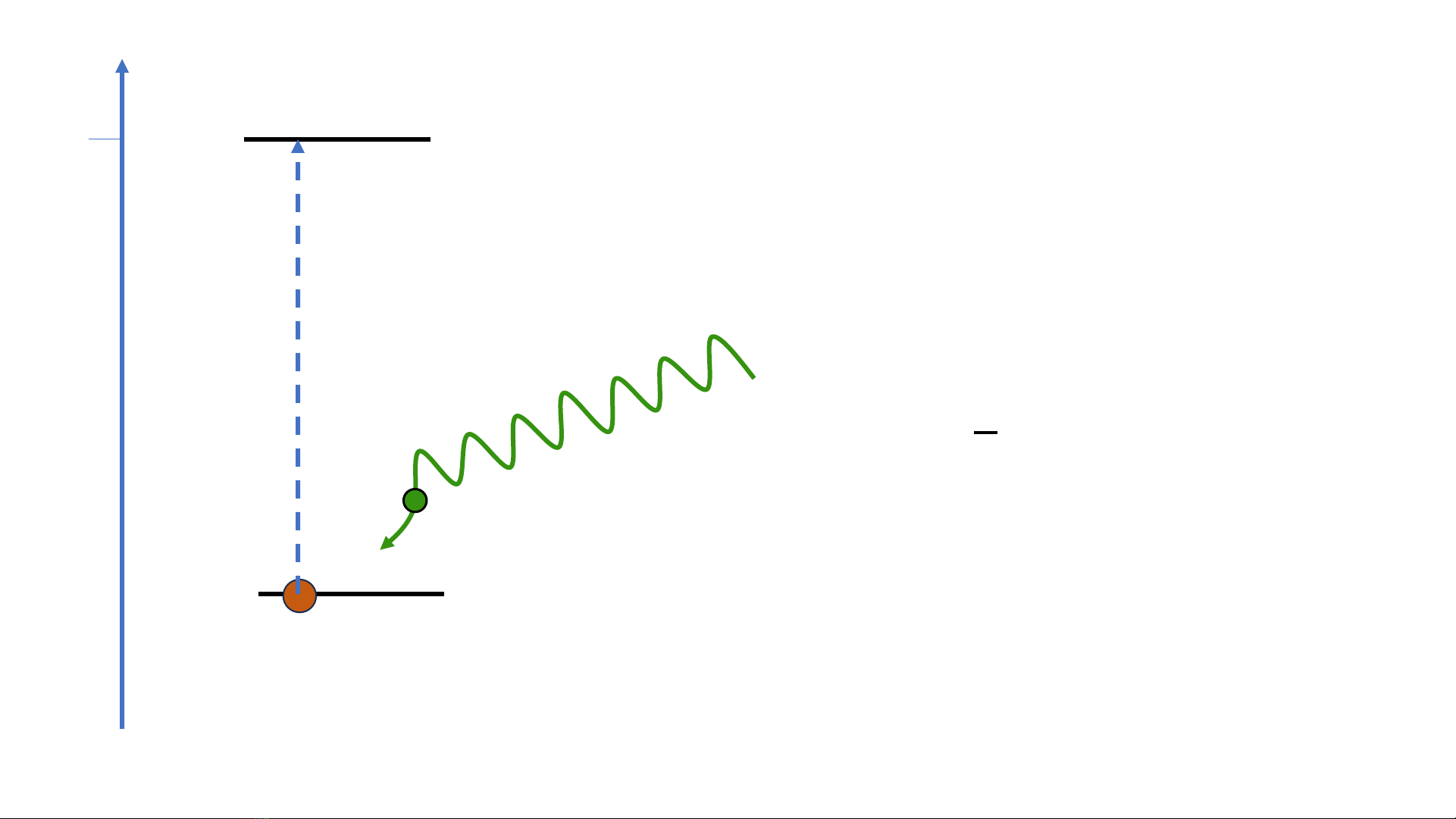
✓Năng lượng Eo trong hiện tượng quang điện là năng lượng liên kết của electron ở
lớp bề mặt của mạng tinh thể kim loại chứ không phải là năng lượng ion hóa.
✓Năng lượng ion hóa nguyên tử (hoặc ion), thường được gọi ngắn gọn là năng
lượng ion hóa, là năng lượng cần thiết để lấy electron ra khỏi nguyên tử (hoặc
ion) cô lập ở trạng thái khí.
2
Kiến thức liên quan câu a
+
-
∞
Ion hóa nguyên tử
3
∞
0
Eion hóa Cs = 3,89 eV
-
Eánh sáng= h c
λ
Để ion hóa được nguyên tử Cs
thì Eánh sáng > Eion hóa Cs
Kiến thức liên quan câu a
Năng lượng ion hóa nguyên tử

4
Cách giải câu a
Bước 1:
•Tìm năng lượng E của quang tử (photon) của ánh sáng có bước sóng đã
cho.
Bước 2:
•So sánh giá trị của E và Eo. Nếu E > Eo thì ánh sáng đã dùng có thể ion hóa
được nguyên tử Ce.

5
Giải câu a
• Năng lượng liên kết của electron ở lớp bề mặt của mạng tinh thể kim loại Cs:
Eo Ce = 3,89 eV = 3,89 eV x 1,602 x10-19 J/eV = 6,231 x 10-19 J
• Năng lượng của quang tử (photon) của ánh sáng có bước sóng 5830 Å:
E = h𝑐
𝜆 = 6,625 x 10−34(J. s) 3.00 × 108 m/s
5830 × 10−10 (m)
= 3,409 x 10−19 J = 2,13 eV
•So sánh giá trị của E và Eo ta thấy E = 2,13 eV < Eo Ce = 3,89 eV nên không
thể ion hóa được nguyên tử Cs.




















![Bộ câu hỏi lý thuyết Vật lý đại cương 2 [chuẩn nhất/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251003/kimphuong1001/135x160/74511759476041.jpg)
![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)




