
CHƯƠNG III
CÂN BẰNG HÓA HỌC
§1 Khái niệm cân bằng hóa học
§2 Sự chuyển dịch cân bằng - các yếu tố ảnh
hưởng
§3 Cách tính hằng số cân bằng hóa học

§1 KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
I. Phản ứng thuận nghịch và cân bằng hoá học
1. Phản ứng 1 chiều là phản
ứng hóa học xảy ra cho đến
khi chỉ còn lại một lượng
không đáng kể chất phản ứng.
Khi viết phương trình phản
ứng ta chỉ dùng dấu mũi tên
một chiều thay cho dấu
bằng.
2
VD:
NaOH + H2SO4 → Na2SO4 +H2O
Zn + 2HCl → ZnCl2 + H2
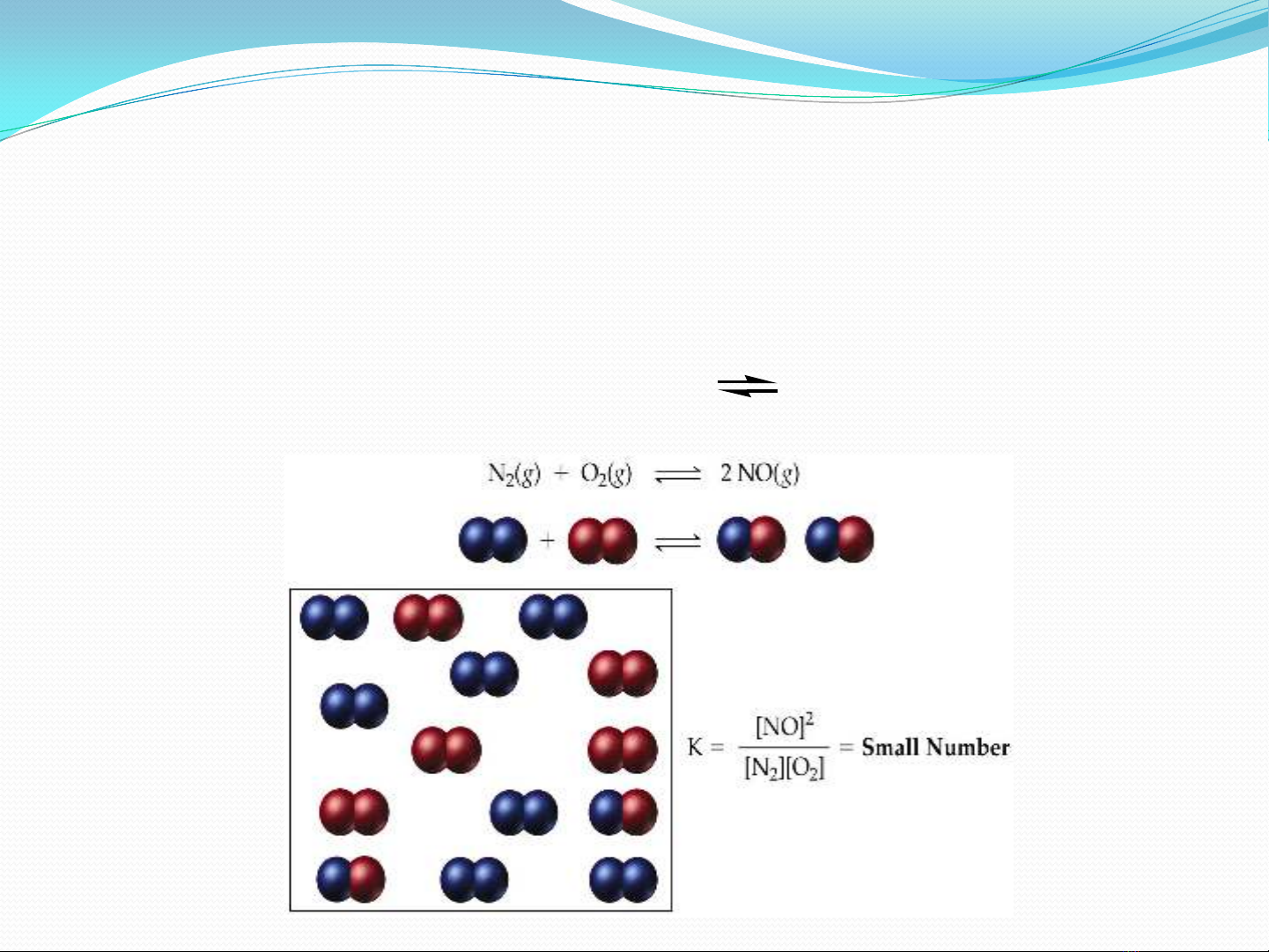
2. Phản ứng thuận nghịch (phản ứng 2 chiều) là phản ứng
mà ở trong cùng một điều kiện phản ứng có thể xảy ra theo
hai chiều ngược nhau. Khi viết phương trình phản ứng ta
phải dùng 2 mũi tên ngược chiều thay cho dấu bằng.
I. Phản ứng thuận nghịch và cân bằng hoá học
3

3. Trạng thái cân bằng hóa học
Tất cả các phản ứng thuận nghịch đều diễn ra
không đến cùng mà chỉ diễn ra cho đến khi đạt được
trạng thái cân bằng hóa học
Ở trạng thái cân bằng hóa học, hàm lượng các
chất phản ứng cũng như hàm lượng sản phẩm tồn tại
không đổi
Cân bằng này là cân bằng động vì phản ứng ở cả
hai chiều thuận và nghịch luôn diễn ra với vận tốc như
nhau
4
I. Phản ứng thuận nghịch và cân bằng hoá học

I. Phản ứng thuận nghịch và cân bằng hóa học
Điều kiện nhiệt động để có cân bằng của phản ứng ở
nhiệt độ T
∆GT = ∑µi . ni = 0
Trong đó: µi : Thế hóa học của chất i
ni : hệ số tỷ lượng của chất i trong phương
trình phản ứng (với chất tham gia phản ứng ni < 0 với
chất sản phẩm ni > 0 )
Với các chất khí lý tưởng ta có
µi = µi0 + R.T.lnpi
5


![Bài tập trắc nghiệm Hóa đại cương [kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250811/nganga_01/135x160/40711754905793.jpg)























