nvhoa102@yahoo.com Chương 8 1
CHƯƠNG 8 – NGUYÊN TỐ CHUYỂN TIẾP
I. ĐẶC ĐIỂM CÁC NGUYÊN TỐ CHUYỂN TIẾP
II. PHỨC CHẤT
1. Khái niệm
2. Cấu tạo phức chất
3. Lý thuyết tạo phức
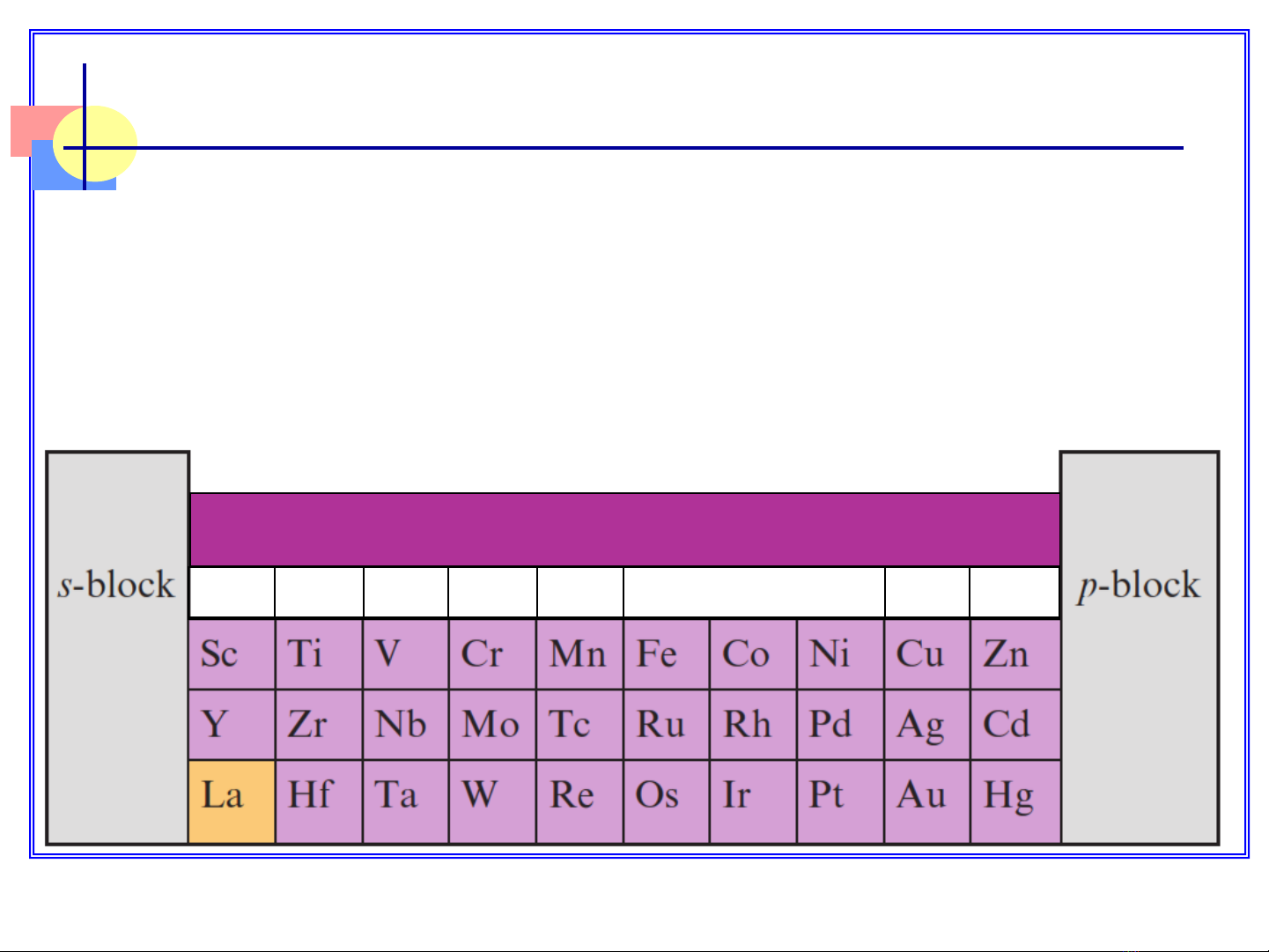
IIIB
VIB
VB
VIB
VIIB
VIIIB IB IIB
d-block
nvhoa102@yahoo.com Chương 8 2
I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP
I.1.Đặc điểm cấu tạo:
Các nguyên tố chuyển tiếp là các nguyên tố d (có e-
cuối cùng sắp xếp vào AO (n-1)d)
– Cấu hình electron hóa trị của nguyên tố d:
Nhóm III IV VVI
Cấu hình e (n1)d1ns2(n1)d2ns2(n1)d3ns2(n1)d5ns1
Nhóm VII VIII III
Cấuhình e(n1)d5ns2(n1)d6,7,8ns2(n1)d10ns1(n1)d10ns2
nvhoa102@yahoo.com Chương 8 3
-Số e’ hóa trị = số e’ phân lớp s lớp ngoài cùng
+ số e’ phân lớp d lớp kề lớp ngoài cùng = STT
của nhóm.
-Có 1 số ngoại lệ trong cấu trúc e’ ở PN VIB, IB,
IIB và PN VIIIB.
I.1.Đặc điểm cấu tạo:
I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP
nvhoa102@yahoo.com Chương 8 4
I.2. Đặc tính chung
-Chỉ có khả năng cho e Các KL
-Có nhiều trạng thái oxihóa dương khác nhau và cách
nhau 1 đơn vị: từ +1 đến STT nhóm
-Số oxihóa dương cực đại = STT của nhóm
(Ngoại lệ: Au, Cu)
-Hợp chất có trạng thái oxihóa dương thấp (< 3): KL
-Hợp chất có trạng thái oxihóa dương cao ( 4) : PK
- Nguyên tố d dễ tạo thành các phức chất
I. CAÙC NGUYEÂN TOÁ CHUYEÅN TIEÁP
nvhoa102@yahoo.com Chương 8 5
II. PHỨC CHẤT
–Các phân tử, ion có thể kết hợp với nhau tạo PC:
CoCl3+ 6NH3= [Co(NH3)6]Cl3
Fe2+ + 6CN = [Fe(CN)6]4
BF3+ F-= [BF4]-
– Định nghĩa phức chất (ở trạng thái rắn và dung dịch):
Phức chất là hợp chất ở nút mạng tinh thể có chứa
các ion phức tích điện dương hay âm (ion phức) có khả
năng tồn tại độc lập trong dung dịch.
II.1. Khái niệm chung











![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)














