nvhoa102@yahoo.com Chương 11 1
CHƯƠNG 11 – PHÂN NHÓM VIB
I. NHẬN XÉT CHUNG
II. CÁC ĐƠN CHẤT
III. HỢP CHẤT CÓ SỐ OXI HÓA (+2), (+3), (+6)
nvhoa102@yahoo.com Chương 11 2
Gồm Cr, Mo, W
Cấu hình electron hóa trị: (n-1)d5ns1(Cr,Mo)
5d46s2(W)
Có khuynh hướng cho các e-số oxihóa +1
đến +6
Trạng thái oxihóa dương bền nhất +6
(Cr còn có trạng thái bền +3, +2)
I.NHẬN XÉT CHUNG
nvhoa102@yahoo.com Chương 11 3
oxihóa dương thấp
tính chất giống kim loại
Cao (+6)
Phi kim (S)
Bazơ Axit
Phức cation
Phức anion
Số phối trí đặc trưng : 6 (còn có SPT 4)
Cr là nguyên tố có nhiều ứng dụng quan trọng.
I.NHẬN XÉT CHUNG
nvhoa102@yahoo.com Chương 11 4
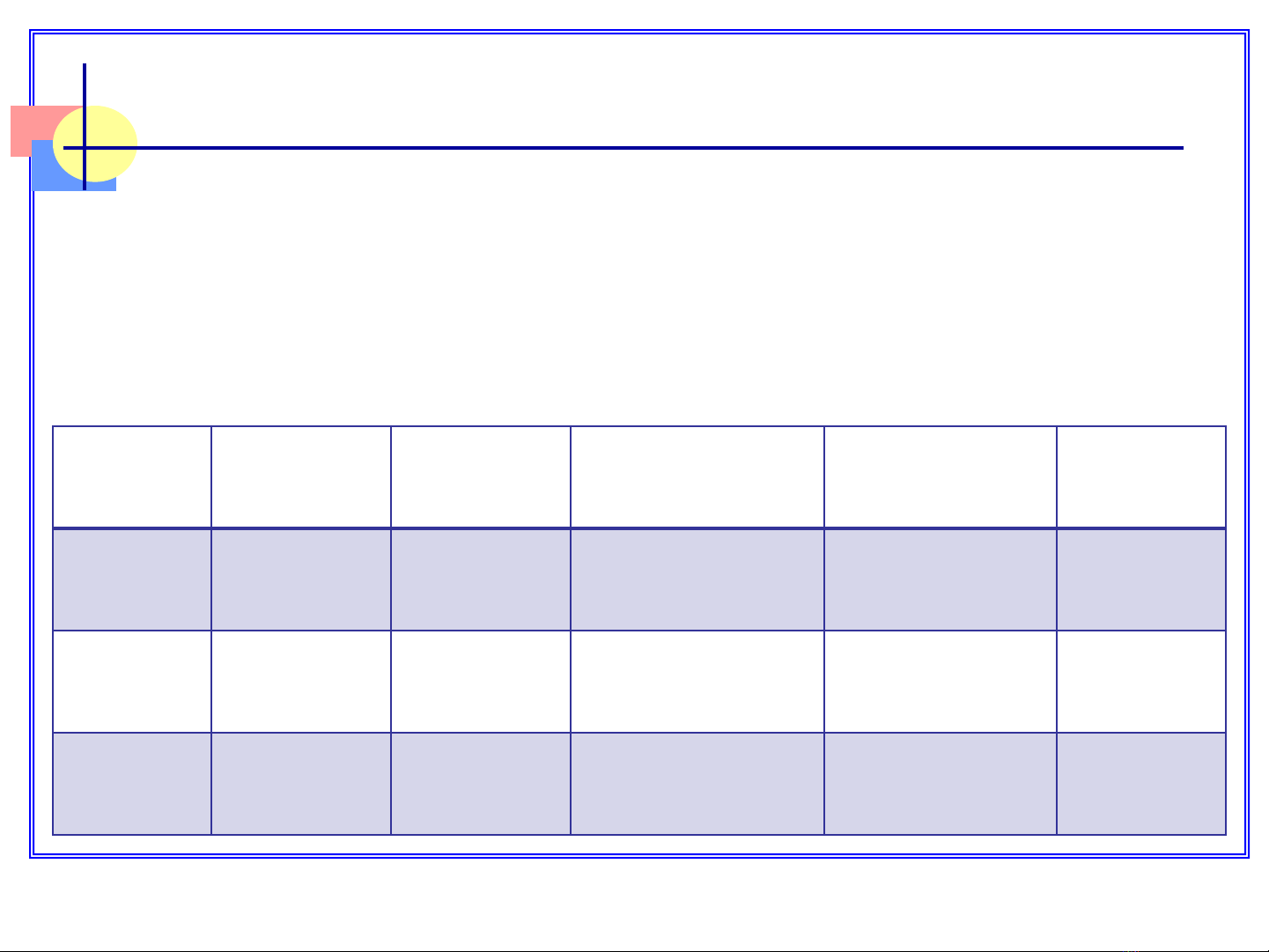
Lý tính:
Là những kim loại trắng bạc, cứng, t0nóng chảy và
t0sôi cao (tăng từ Cr đến W)
II. CÁC ĐƠN CHẤT
Kim
loại
T0nc, 0C T0s, 0CĐộ cứng
(thang Moxơ)
Độ dẫn điện
(Hg=1)
0M3+/M
,
V
Cr 1875 2197 5 7,1
- 0,74
Mo 2610 5560 5,5 20,2 - 0,2
W3410 5900 4,5 19,3
- 0,15

nvhoa102@yahoo.com Chương 11 5
II. CÁC ĐƠN CHẤT
Hoá tính:
-Là kim loại hoạt động, hoạt tính giảm từ Cr W
-Ở điều kiện thường bền với không khí và nước.
-Khi đốt nóng, bột những kim loại này bị nhiều chất
oxi hóa
2Cr + 3/2 O
2Cr2O3
Mo + 3/2O
2MoO3
W + 3/2 O
2WO3
2Cr + 3H
2O Cr2O3+ 3H2
Mo + 2H
2O MoO2+ 2H2
W + 2H
2O WO2+ 2H2











![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)














