
Ch ng V: ươ
DUNG D CH Ị
CÂN B NG L NG H IẰ Ỏ Ơ
I.Đi c ng v dung d ch ạ ươ ề ị
II.S hòa tan c a ch t khí trong ch t l ng ự ủ ấ ấ ỏ
III.S hòa tan c a ch t l ng trong ch t l ng ự ủ ấ ỏ ấ ỏ
Cân b ng l ng – h i ằ ỏ ơ

I. ĐI C NG V DUNG D CH Ạ ƯƠ Ề Ị
Dung d ch là ịh n h p đng thỗ ợ ồ ể c a ủhai
hay nhi u ch tề ấ hoàn toàn tr n l n vào ộ ẫ
nhau.
Dung d ch l ng ị ỏ
Dung d ch r n ị ắ
Dung d ch g m:ị ồ
Dung môiKý hi u ệ1 (x1)
Ch t tanấ Ký hi u ệi = 2, .. n (xi)
05/18/22 2
607010 - Ch ng 5ươ

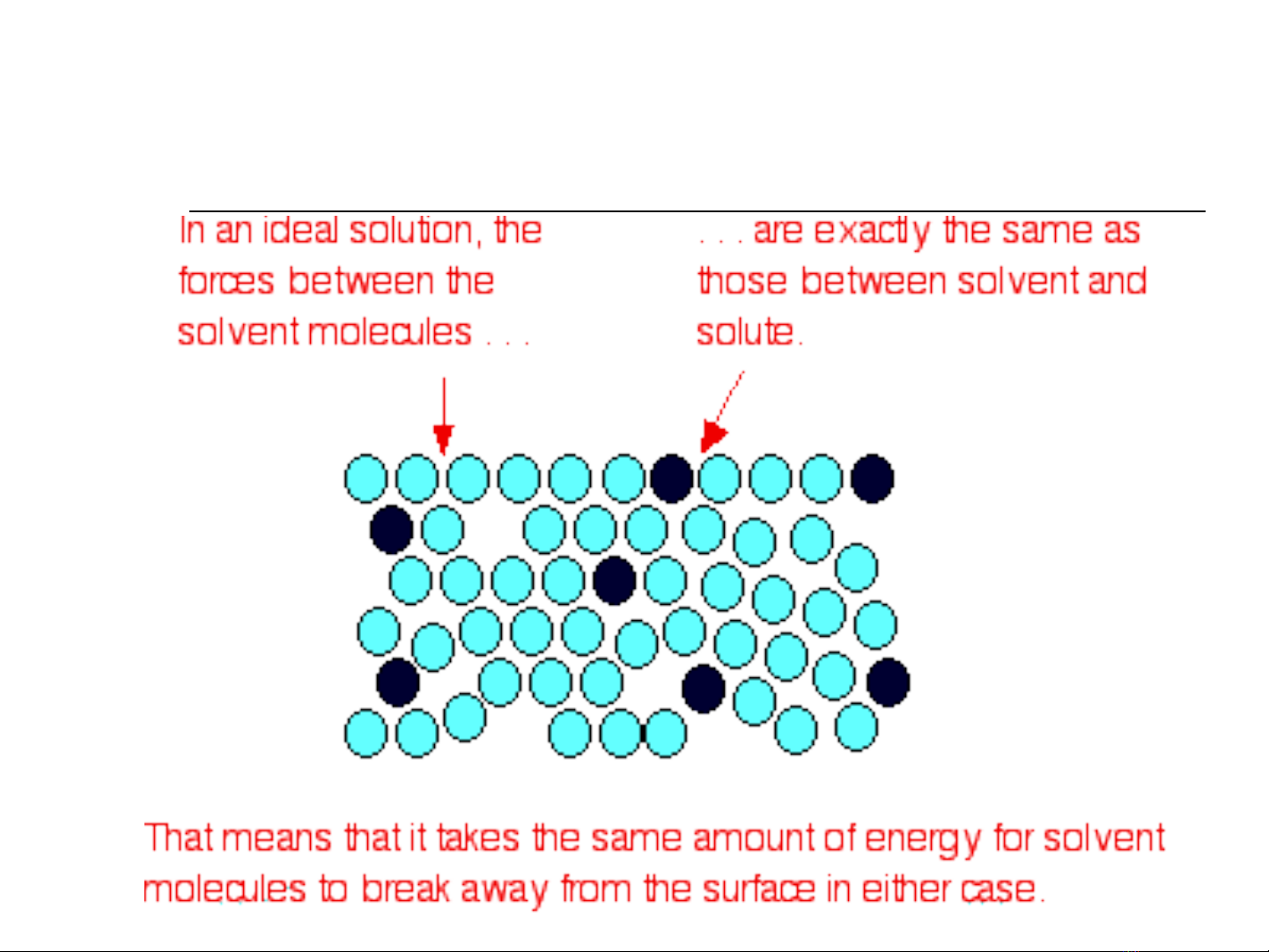
Dung d ch lý t ng:ị ưở
Các c u t có tính ch t lý, hóa gi ng nhau ấ ử ấ ố
l c t ng tác gi ng nhau: ự ươ ố
fA-A = fB-B = fA-B
T o dung d ch không gây hi u ng: ạ ị ệ ứ
U = 0; H = 0; V = 0
Tuân theo các ph ng trình lý t ng, nh ươ ưở ư
i =i
o+ RTlnxi
PHÂN LO I DUNG D CHẠ Ị
05/18/22 3
607010 - Ch ng 5ươ
Dung d ch lý t ng:ị ưở
05/18/22 4
607010 - Ch ng 5ươ

Dung d ch vô cùng loãng:ị x1 1, xi 0
Tuân theo các ph ng trình lý t ng, nh : ươ ưở ư
-Đnh lu t Henry, ị ậ
-Đnh lu t Raoult,ị ậ
- i =i
o+ RTlnxi
Dung d ch th c (không lý t ng): ị ự ưở
L c t ng tác khác nhau: fự ươ A-A fB-B fA-B
t o thành dung d ch ạ ị U 0; H 0; V 0
Không tuân theo các ph ng trình lý t ng, ươ ưở
ph i s d ng ho t đ â: ả ử ụ ạ ộ i = i
o+ RTlnai
05/18/22 5
607010 - Ch ng 5ươ

![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)



![Bài giảng Nhiệt động lực học hóa học [chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20241106/vipanly/135x160/371730886770.jpg)





![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













