a a
Copyright © 2009 volcmttl@yahoo.com.vn 1
DNG CÂU HI LÍ THUYT
Câu 1: Vit phng trình phn ng xy ra trong nhng trng hp sau:
1. Ozon oxi hóa I- trong môi trng trung tính
2. Sc khí CO2 qua nc Javel
3. Cho nc Clo qua dung dch KI
4. Sc khí Flo qua dung dch NaOH loãng lnh
5. Hòa tan Photpho trng trong dung dch Ba(OH)2, sau ó axit hóa dd sau phn ng bng H2SO4
6. Cacborunum tan trong dung dch KOH nóng chy khi có mt không khí
7. Ion Fe2+ phá hy phc iclorotetraamincoban(II) trong môi trng axit
8. Sc Clo n d vào dung dch FeI2
Hng dn gii
1. O3 + 2I- + H2O
→
O2 + I2 + 2OH-
2. CO2 + NaClO + H2O
→
NaHCO3 + HClO
3. Cl2 + 2KI
→
2KCl + I2 ; Nu KI còn d: KI + I2
→
KI3
4. 2F2 + 2NaOH(loãng, lnh)
→
2NaF + H2O + OF2
5. 2P4 + Ba(OH)2 + 6H2O
→
3Ba(H2PO2)2 + 2PH3 ; Ba(H2PO2)2 + H2SO4
→
BaSO4 + 2H3PO2
6. SiC + 4KOH(nóng chy) + 2O2
→
K2SiO3 + K2CO3 + 2H2O
7. [CoCl2(NH3)4]+ + Fe2+ + 4H+
→
Co2+ + Fe3+ + 2Cl- + NH4+
8. 2FeI2 + 3Cl2
→
2FeCl3 + 2I2 ; 5Cl2 + I2 + 6H2O
→
2HIO3 + 10HCl
Câu 2: Nêu phng pháp hóa hc tách:
a. Khí N2 ra khi khí NO
b. Ion Be2+ ra khi ion Al3+ trong dung dch mui nitrat ca chúng. Nêu c s khoa hc ca phng pháp
tách ã dùng.
Hng dn gii:
1. Cho qua dd FeSO4, NO b hp th, N2 bay ra: FeSO4 + NO
→
Fe[NO]SO4 un nóng dd li c NO
2. Cho Na2CO3 n d vào dung dch. Al3+ tách ra di dng Al(OH)3 còn Be2+ còn li di dng
[Be(CO3)2]2-. Hòa tan Al(OH)3 vào HNO3 ly li Al3+. Axit hóa dung dch ly li Be2+
Al3+ + 3
2
3
CO
−
+ 3H2O
→
Al(OH)3 + 3CO2 Be2+ + 2
2
3
CO
−
[Be(CO3)2]2- tan
Al(OH)3 + 3H+
→
Al3+ + 3H2O [Be(CO3)2]2- + 4H+
→
Be2+ + 2CO2 + 2H2O
C s ca phng pháp này là: Ion Be2+ có bán kính bé có kh nng to phc vi ion cacbonat còn Al3+
thì không có kh nng này
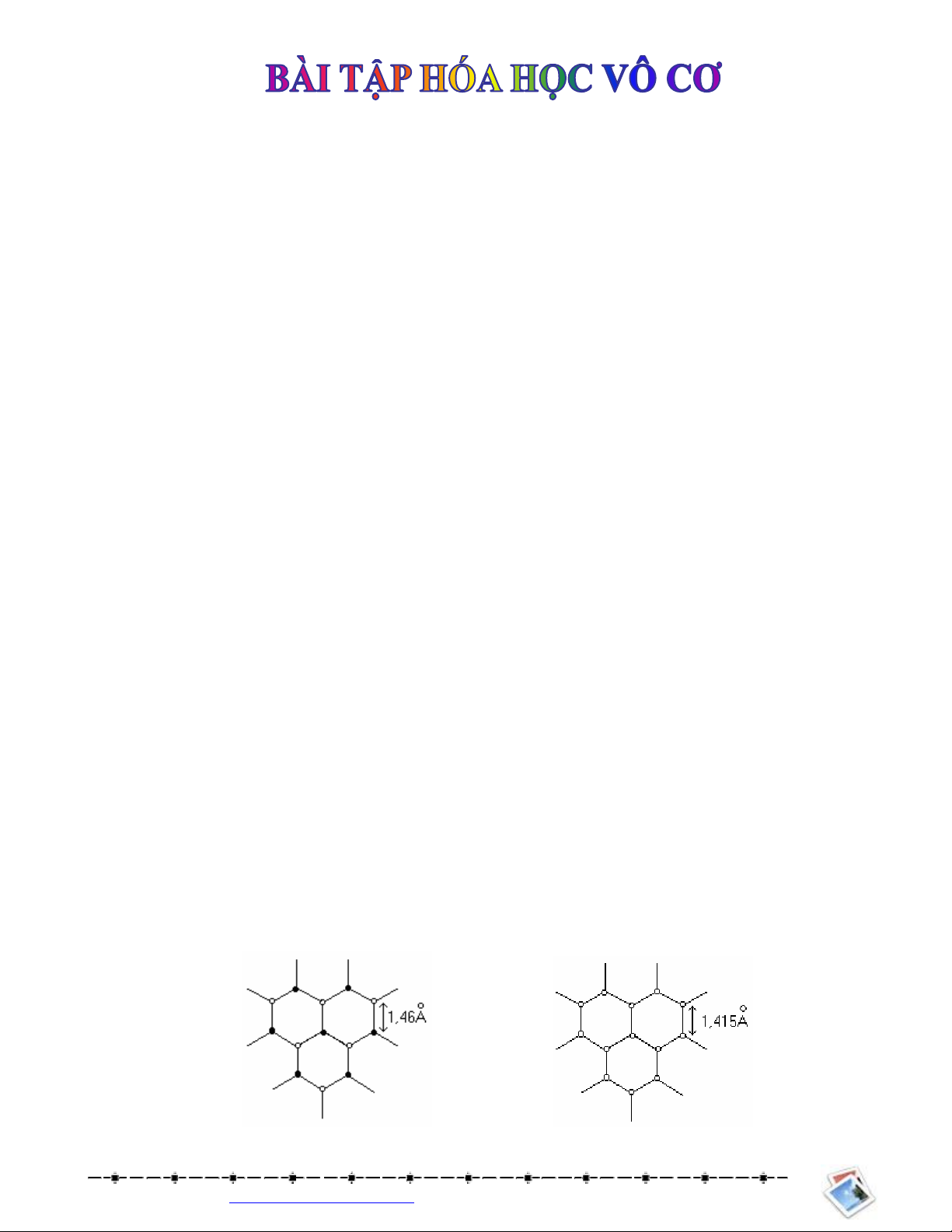
Câu 3: Mt dng tinh th ca Bonitrua [công thc (BN)n] có tên gi là than chì trng. Hãy cho bit tinh th
than chì trng có nhng im gì ging tinh th than chì en.
Hng dn gii:
- Các nguyên t B, N u lai hóa sp2, to nên các lp bng lc giác u. Liên kt gia các nguyên t trong
mt lp là liên kt cng hóa tr, liên kt gia các lp là liên kt vandervan
- Khong cách gia các nguyên t trong mt lp và khong cách gia các lp cng tng t cacbon than
chì, gn ging vòng benzen
- Mô hình:
Bonitrua Cacbon than chì

a a
Copyright © 2009 volcmttl@yahoo.com.vn 2
Câu 4: Phim en trng cha lp ph bc bromua trên nn là xenluloz axetat.
1. Vit phn ng quang hóa xy ra khi chiu ánh sáng vào lp AgBr ph trên phim.
2. Trong quá trình này thì lng AgBr không c chiu sáng s b ra bng cách cho to phc bi dung
dch natri thiosunfat. Vit phng trình phn ng.
3. Ta có th thu h!i bc t" dung dch nc thi bng cách thêm ion xianua vào, tip theo là k m. Vit các
phn ng xy ra.
Hng dn gii:
1. Phn ng: h
(r) (r) 2
2AgBr 2Ag + Br /2Br
ν
•
→
2. AgBr(r) + 2Na2S2O3 # Na3[Ag(S2O3)2] + NaBr
3. 3
2 3 2 2 2 3
[Ag(S O ) ] + 2CN [Ag(CN) ] + 2S O
− − − −
→
2 +
2 4
2[Ag(CN) ] + Zn [Zn(CN) ] + 2Ag
− −
→
Câu 5: Mt vài tính cht ca mt hp cht vô c cha bit A c li$t kê di ây:
- A là mt cht rn màu trng hi vàng, d% chy ra và thng hoa khi un nóng. A có KLPT là 266.
- A phn ng mãnh li$t vi nc cho dung dch B.
- Khi mt dung dch h&n hp g!m NH4OH và NH4Cl c thêm vào dung dch B thì nh'n c kt ta
keo màu trng.
- Mt m(u dung dch B phn ng vi dung dch h&n hp nitric axit và bc nitrat cho kt ta vón cc màu
trng C. Kt ta trng này nhanh chóng tan i khi thêm vào dung dch NH4OH mc dù khi ta cho d
NH4OH thì li xut hi$n kt ta trng D.
- Kt ta D c lc và hoà tan trong NaOH thu c dung dch trong sut E.
- Khi cho khí CO2 li qua dung dch E thì li sinh ra kt ta D.
- Cht A hoà tan không i$n ly trong ete không l(n nc. Khi dung dch này phn ng vi LiH thì s to
thành sn ph)m F. Nu dùng d LiH thì F s chuyn thành G.
a. Xác nh cht A.
b. Xác nh các cht t" B n G và vit tt c các phng trình phn ng xy ra.
Hng dn gii
a. Trong bc th ba ca phép phân tích ta thu c kt ta trng keo, iu này chng t rng dung dch B
có cha Al3+
và dung dch B cng to kt ta trng vi AgNO3, kt ta này tan i khi ta thêm NH4OH vào
chng t rng dung dch B có cha Cl-. V'y cht A s là Al2Cl6 (MA = 266).
b. Các phn ng xy ra:
Al2Cl6 + 12H2O = 2[Al(H2O)6]3+
+ 6Cl-
6AgNO3 + 6Cl-
= 6AgCl + 6NO3-
AgCl + 2NH4OH = [Ag(NH3)2]+Cl- + H2O
Al3+
+ 3NH4OH = Al(OH)3 + 3NH4
+
Al(OH)3 + NaOH = Na+[Al(OH)4
-
]
[Al(OH)4]-
+ CO2 = Al(OH)3 + HCO3-
Al2Cl6 + LiH = (AlH3)n + LiHd = LiAlH4
Câu 6: Canxi xianamit (CaCN2) là mt loi phân bón a nng và có tác dng tt. Nó có th c sn xut rt
d% dàng t" các loi hóa cht thông thng nh CaCO3. Qúa trình nhi$t phân ca CaCO3 cho ra mt cht rn
màu trng XA và mt khí không màu XB không duy trì s cháy. Mt cht rn màu xám XC và khí XD c
hình thành bi phn ng kh XA vi cacbon. XC và XD còn có th b oxy hóa to thành các sn ph)m có
mc oxy hóa cao hn. Phn ng ca XC vi nit cui cùng cng d(n ti vi$c to thành CaCN2.
1. Vit tt c các phng trình phn ng xy ra.
a a
Copyright © 2009 volcmttl@yahoo.com.vn 3
2. Khi thu* phân CaCN2 thì thu c cht gì? Vit phng trình phn ng
3. Trong hóa hc cht rn thì ion CN22--
có th có !ng phân. Axit ca c hai anion u ã c bit (ch+ t!n
ti trong pha khí). Vit công thc cu to ca c hai axit và cho bit cân bng chuyn hóa gia hai axit
trên dch chuyn v phía nào?
Hng dn gii
1. CaCO3
→
CaO + CO2
CaO + 3C
→
CaC2 + CO
CaC2 + N2
→
CaCN2 + C
Quá trình trên c gi là quá trình Frank – Caro. Quá trình này rt quan trng trong k, thu't.
2. CaCN2 + 3H2O # CaCO3 + 2NH3
3. Công th ca hai !ng phân là:
HN = C = NH
N - C – NH2
Hp cht u tiên là axit ca anion cacbondiimit và hp cht th hai là xianamit.
Cân bng s chuyn dch v phía to thành hp cht có tính i xng cao hn.
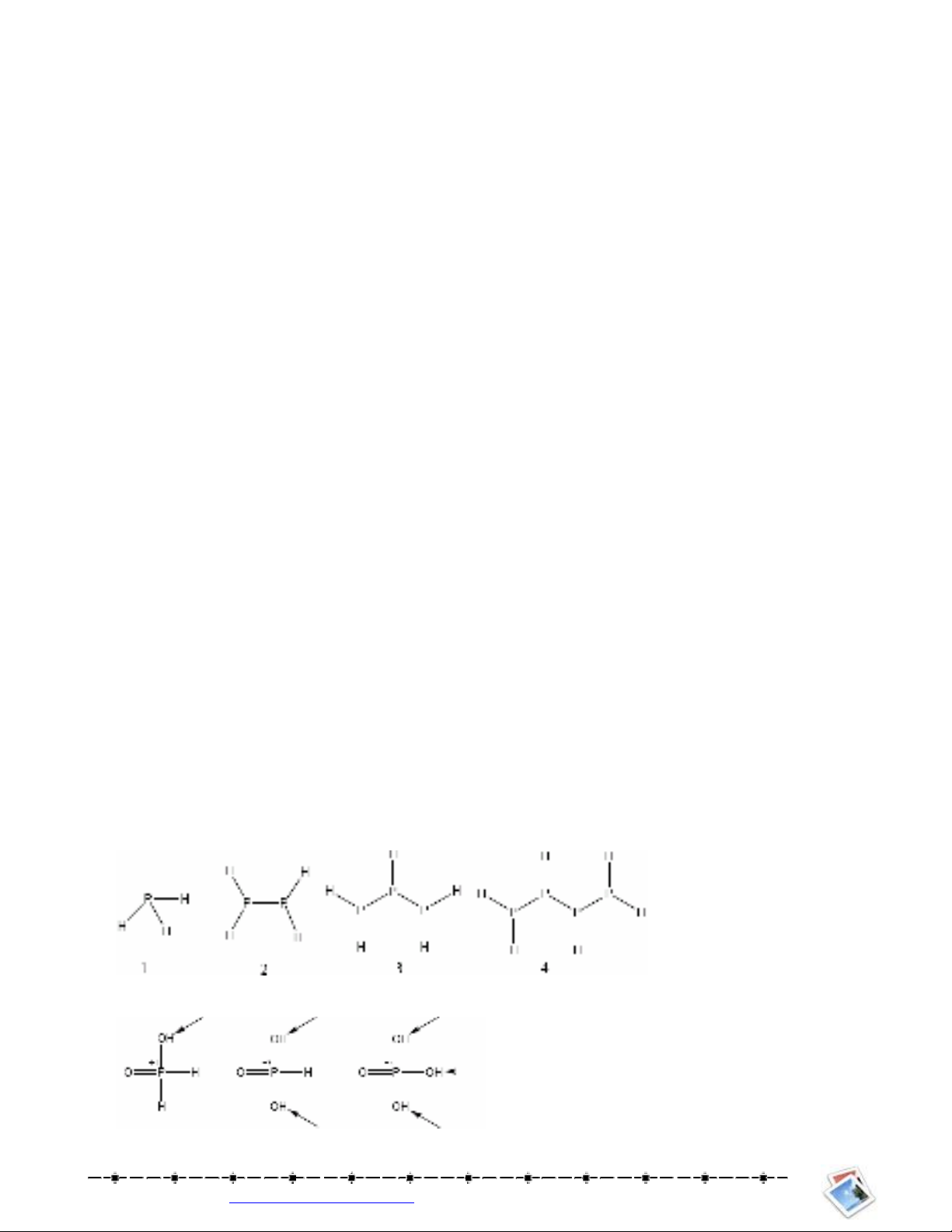
Câu 7: Nguyên t X (có nhiu dng thù hình) có mt anion cha oxy óng vai trò quan trng trong ô nhi%m
nc. âm i$n ca nó nh hn oxy. Nó ch+ to hp cht phân t vi halogen. Ngoài hai oxit n phân t
còn có nhng oxit cao phân t. X có vai trò rt quan trng trong sinh hóa. Các obitan p ca nó ch+ có mt
electron.
1. ó là nguyên t nào?. Vit cu hình ca nó.
2. X có th to c vi hidro nhiu hp cht cng hóa tr có công thc chung là XaHb ; dãy hp cht này
tng t nh dãy !ng .ng ca ankan. Vit công thc cu to 4 cht u ca dãy
3. Mt trong s 4 hp cht trên có ba !ng phân l'p th (tng t axit tactric), Xác nh hp cht này.
4. Nguyên t X to c nhng axit có cha oxy (oxoaxit) có công thc chung là H3XOn vi n = 2, 3 và 4.
Vit công thc cu to ca 3 axit này. ánh du (du sao hoc mi tên) các nguyên t H axit và ghi s
oxy hóa ca X trong các hp cht này.
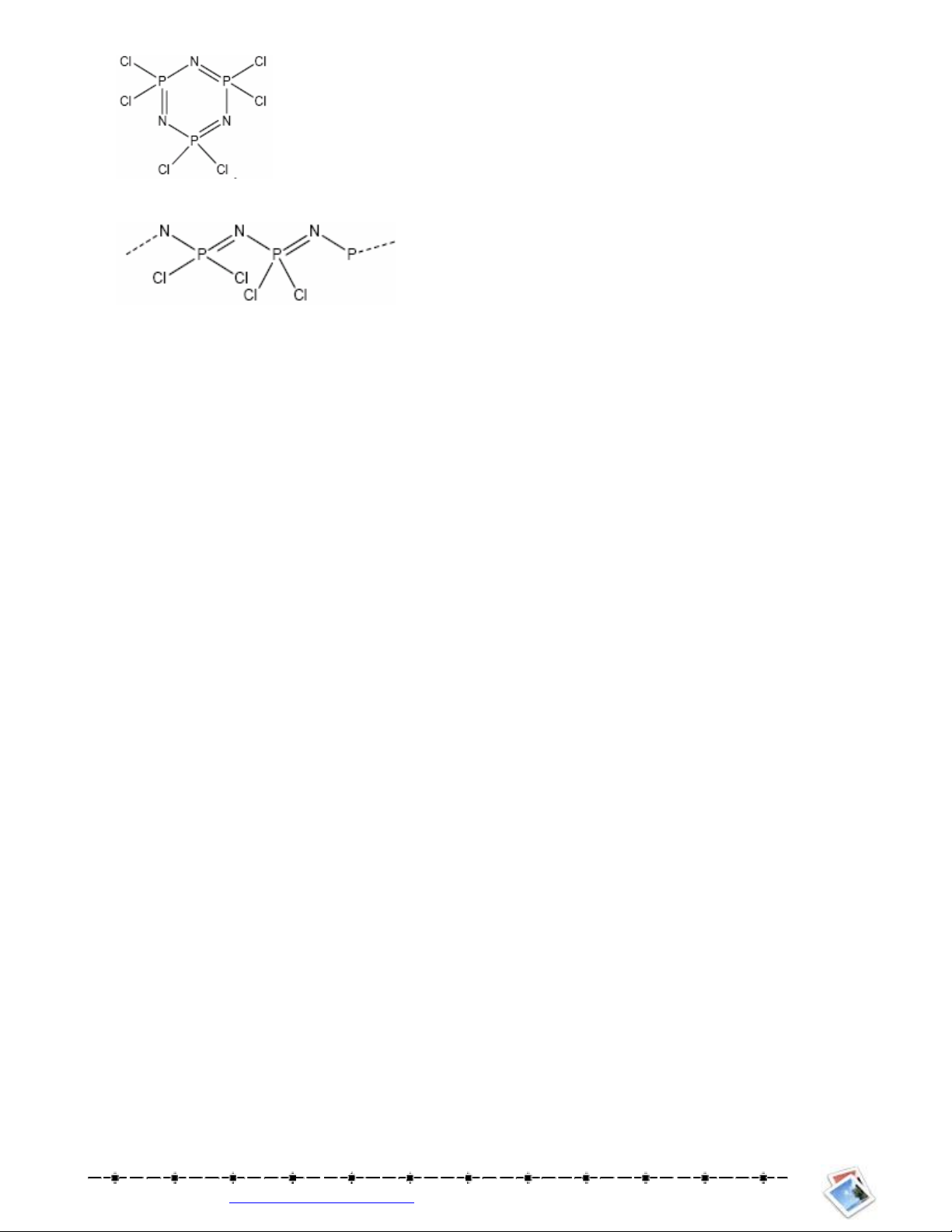
5. Mt hp cht d vòng ca X, vi cu trúc ph.ng do J. Liebig và F.Wohler t/ng hp t" nm 1834, c
to thành t" NH4Cl vi mt cht pentacloro ca X ; sn ph)m ph ca phn ng này là mt khí d% tan
trong nc và phn ng nh mt axit mnh Vit phng trình phn ng và vit công thc cu to ca
hp cht (NXCl2)3
6. Hp cht vô c v"a nêu trên có tính cht khác thng khi b un nóng: nó sôi 256oC khi b un nóng
nhanh. Nu un nóng ch'm nó bt u nóng chy 250oC; làm ngui nhanh cht lng này thì ta c
mt cht tng t cao su. Gii thích tính cht c bi$t này.
Hng dn gii:
1. Phopho có cu hình electron: [Ne]3s23p3
2. Công thc cu to ca 4 hp cht u tiên
3. 4
4. Công thc cu to ca các cht
5. 4 5 2 3
3NH Cl + 3PCl (NPCl ) + 12HCl
→
a a
Copyright © 2009 volcmttl@yahoo.com.vn 4
6. un nóng mnh
→
cht nóng chy không b gãy vòng
un nóng nh0
→
vòng b b1 gãy thành các phân t polime có h$ liên hp pi
Câu 8: Gii thích các hi$n tng sau: SnS2 tan trong (NH4)2S ; SnS không tan trong dung dch (NH4)2S
nhng tan trong dung dch (NH4)2S2.
Hng dn gii
SnS2 là sunfua axit nên tác dng vi (NH4)2S là sunfua baz:
SnS2 + (NH4)2S # (NH4)2SnS3 (*)
SnS là sunfua baz nên không tác dng vi (NH4)2S (sunfua baz). Tuy nhiên, i vi dung dch (NH4)2S2
phn ng có th xy ra vì, trc ht (NH4)2S2 oxi hoá SnS:
SnS + (NH4)2S2 # (NH4)2S + SnS2
sau ó SnS2 to thành s phn ng vi (NH4)2S nh phn ng (*).
Câu 9: Vit các phng trình phn ng xy ra:
1. Ion I- trong KI b oxi hoá thành I2 bi FeCl3, O3 ; còn I2 oxi hoá c Na2S2O3.
2. Ion Br- b oxi hoá bi H2SO4c, BrO3- (mt axit) ; còn Br2 li oxi hoá c P thành axit tng ng.
3. H2O2 b NaCrO2 kh (trong môi trng baz) và b oxi hoá bi dd KMnO4 (trong môi trng axit).
Hng dn gii
1. 2KI + 2FeCl3 2FeCl2 + 2KCl + I2
2KI + O3 + H2O 2KOH + O2 + I2
I2 + 2Na2S2O3 2NaI + Na2S4O6
2 2Br- + 4H+ + SO42-( c) Br2 + SO2 + 2H2O
5Br- + BrO3- + 6H+ 3Br2 + 3H2O
5Br2 + 2P + 8H2O 10 HBr + 2H3PO4
3 3H2O2 + 2NaCrO2 + 2NaOH 2Na2CrO4 + 4H2O
5H2O2 + 2KMnO4 + 3H2SO4 2MnSO4 + K2SO4 + 5O2 + 8H2O
Câu 10: Nung chy Fe2O3 vi h&n hp NaNO3 và Na2CO3 thu c mt cht rn màu tím , lâu trong
không khí cht này to thành kt ta nâu và có khí thoát ra. Vit các phng trình xy ra
Câu 11: Vit phng trình phn ng xy ra trong các quá trình hoá hc sau:
1. Hoà tan bt chì vào dung dch axit sunfuric c (n!ng > 80%)
2. Hoà tan bt Cu2O vào dung dch axit clohidric 'm c d.
3. Hoà tan bt st vào dung dch axit sunfuric loãng, sau ó thêm nc clo n d vào dung dch thu c.
4. mt v't làm bng bc ra ngoài không khí b ô nhi%m khí H2S mt thi gian.
Câu 12: Kim loi A có màu trng bc và có ánh kim. Trong công nghi$p, ngi ta dùng kim loi A m lên
các ! v't bng kim loi bo v$ cho kim loi không b g+, lp m thng ch+ dày vào khong 0,005mm.
Hiroxit ca A là cht B có dng A(OH)2, B là cht kt ta màu vàng nhng thng l(n tp cht nên có màu
hung. Khi tip xúc vi không khí, B chuyn thành C là cht nhy có màu lc nht, không tan trong nc
nhng tan c trong c dung dch kim cng nh dung dch axit. Cht B tan trong dung dch HCl d cho
dung dch D có màu xanh lam nhng khi cô cn dung dch thì li c mui rn khan màu trng, hút )m
mnh. Cho dung dch D tác dng vi dung dch CH3COONa c thu c kt ta ít tan màu E. E dng
ime là hp cht có cu to c bi$t và là mt trong nhng hp cht d% iu ch và bn nht ca A(II). Nêu
bn cht liên kt ca A trong ime E. Tìm các cht t" A n E và vit các phng trình xy ra.

a a
Copyright © 2009 volcmttl@yahoo.com.vn 5
Câu 13: MnO là cht bt màu xám lc, không tan trong nc nhng tan trong dd axit to thành mui
Mn(II). Khi un nóng MnO trong không khí 200-300oC, nó bin thành cht B có màu en. un nóng B
trong dung dch KOH c, nó to nên dung dch màu xanh lam C còn nu un nh0 B trong HCl c d thì thu
c dung dch D và thy có khí màu vàng lc bay ra. Cho lng d dung dch KOH vào dung dch D.
- Nu thc hi$n phn ng trong khí quyn hiro thì to kt ta màu trng E
- Nu thc hi$n phn ng trong không khí thì li thu c kt ta màu nâu F
Sc Cl2 vào h/n hp ca E và KOH li thu c B. Xác nh B, E, F và thành phn các dung dch C, D. Vit
các phng trình phn ng ã xy ra.
Câu 14: Cht A màu trng, không nhy. Khi A trong không khí, A chuyn thành h&n hp cht B có màu
lc r!i chuyn thành cht C có màu nâu . Hòa tan A trong dung dch HCl d, sau ó cô cn và cho lng
d dung dch NH3 bão hòa vào thu c dung dch D. Thêm nc d vào dung dch D li thu c A. Nung
A trong không khí thu c cht rn E. E cng c to thành khi nung C. E không tan trong kim loãng
nhng tan trong kim nóng chy to thành cht F. Hòa tan F trong nc thu c C. Xác nh các cht và
vit các phng trình hóa hc ã xy ra bit A là hp cht ca Fe.
Câu 15: Kim loi X cháy trong không khí to thành X1 có màu en. Hòa tan X1 trong dung dch HCl thu
c dung dch X2 có màu xanh lam. Cô cn dung dch X2 c cht X3 dng tinh th có màu nâu và là
polime vô c. Còn nu kt tinh dung dch X2 li c X4 li là nhng tinh th màu lc cng có cu trúc
polime. Hòa tan X1 trong dung dch H2SO4 thu c dung dch X5 có màu lam. Sc NH3 vào dung dch X5
ban u có kt ta màu xanh sau tan ra to dung dch X6. Dung dch X5 phn ng vi NaCN thu c ixian.
Vit công thc polime X3, X4. Xác nh các cht, thành phn các dung dch và hoàn thành tt cc các phng
trình phn ng ã xy ra.
Câu 16: Vit các phng trình xy ra trong các trng hp sau:
1. AuCl3 có tính oxi hóa mnh, có th tham gia phn ng vi các dung dch H2O2, FeSO4, Na2S2O3
2. Khi un nóng vi SnCl2, FeCl2 thì !ng (II) oxit b kh thành mui !ng (I)
3. Cu2O tan trong kim c to thành cuprit
4. Au có th tan trong dung dch NaCN khi có mt O2 không khí
5. Au(OH)3 có tính cht l2ng tính, có th tan trong dung dch NaOH cng nh dung dch HNO3
Câu 17: Xác nh các cht và hoàn thành các phng trình phn ng sau:
1. A + O2 o
t
→
B + SO2
2. A + CaO o
t
→
B + CaSO4 + CaS
3. A + K2S(c)
→
Kali thiomecurat
4. C + H2S
→
A + HCl
5. A + HNO3 + HCl o
t
→
C + H2SO4 + NO + H2O
6. C + NH3(c)
→
Hg(NH3)2Cl2 (NH3 c trong lng d NH4Cl)
Câu 18: Vit công thc dng cis và trans ca ion phc bát di$n [Co(NH4)4Cl2]+. Nh'n xét v v trí tng i
ca 2 nguyên t Cl i vi nguyên t" Co trung tâm
Câu 19: S oxi hóa I- bi
2
2 8
S O
−
c xúc tác bi ion Fe2+ cng nh Fe3+
1. Cn làm nhng thí nghi$m nào thy rõ vai trò xúc tác ca ion Fe2+ cng nh Fe3+
2. Gii thích c ch xúc tác
3. Hãy rút ra kt lu'n v th oxi hóa – kh ca cht xúc tác
Câu 20: Có hi$n tng gì xy ra khi cho Bari kim loi vào các dung dch sau: MgCl2, FeCl2, Al(NO3)3,
(NH4)2SO4. Vit các phng trình phn ng di dng phng trình ion minh ha.
Câu 21: Gii thích:
a. Vì sao khi cho d NH4Cl vào dung dch NaAlO2 r!i un nóng thì có kt ta keo trng xut hi$n.
b. Cho bit: Ion Fe3+ to vi ion thioxyanat
SCN
−
phc Fe(SCN)3 màu máu, và to vi ion
F
−
phc
3
6
FeF
−
bn hn Fe(SCN)3. Gii thích hi$n tng xy ra khi thêm t"ng git NaF vào dung dch Fe(NO3)3
và KSCN cho n d.












![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













