
1
NGHIÊN CỨU CÁC PHỨC ĐA PHỐI TỬ TRONG HỆ
Ho (III)-1-(2-PYRIDYLAZO)-2-NAPHTOL (PAN)-AXIT AXÊTIC
VÀ CÁC DẪN XUẤT CLO CỦA NÓ BẰNG PHƯƠNG PHÁP TRẮC
QUANG
Nguyễn Đình Luyện, Lê Thị Bích Ngọc
Trường Đại học Sư phạm, Đại học Huế
MỞ ĐẦU
Trong các công trình trước, chúng tôi đã thông báo kết quả nghiên cứu sự
tạo phức đơn và đa của nguyên tố đất hiếm Ho(III) với PAR [1] và Ho(III) - PAR
- HX [2]; Ho(III) - PAN [3]. Trong công trình này, chúng tôi tiếp tục thông báo
kết quả nghiên cứu các phức đa phối tử trong hệ Ho(III) -1-(2-pyridylazo) - 2-
naphtol (PAN) - HX (HX: CH3COOH; CH2ClCOOH; CHCl2COOH;
CCl3COOH) trong môi trường nước.

2
PHẦN THỰC NGHIỆM
Dung dịch nguyên tố đất hiếm Ho(III) được điều chế từ Ho2O3 có độ tinh
khiết phân tích, nồng độ của nó được xác định bằng phương pháp chuẩn độ
complexon dùng dung dịch chuẩn DTPA chỉ thị là Asenazo (III) trong đệm
axetat. Các dung dịch được pha chế từ dung dịch gốc. PAN là thuốc thử tinh
khiết được pha chế bằng cách cân một lượng chính xác trên cân phân tích sau đó
hòa tan bằng axêtôn rồi định mức đến vạch cần pha. Các dung dịch PAN loãng
cũng được pha chế từ dung dịch gốc này. PAN tạo phức với nhiều ion như
Fe(III) [4, 5, 6]; Ni(II)... Các dung dịch axit HX, NaOH... cũng được pha chế từ
hóa chất tinh khiết phân tích. pH của dung dịch được đo trên máy pH meter của
hãng Hanan. Mật độ quang được đo trên máy Spectro 2000 (Automain
Spectrophotometer) (Mỹ) và máy UV 1201 Shmadzu (Nhật).
KẾT QUẢ VÀ THẢO LUẬN
1. Hiện ứng tạo phức đa phối tử của hệ Ho(III) - PAN - HX:
Phổ hấp thụ electron của PAN, phức đơn Ho(III) - PAN và các phức đa
phối tử Ho(III) - PAN -HX được biểu diễn trên hình 1. Qua hình 1 cho thấy khi
có mặt của phối tử thứ hai HX thì max của phức chuyển từ 535 nm đến 570 nm
(2 cực đại) và mật độ quang tăng đáng kể, phức của Ho(III) -HX không màu. Vậy
trong các hệ trên đã xảy ra sự tạo phức đa phối tử Ho(III) - PAN - HX. Các thí
nghiệm nghiên cứu tiếp theo được đo ở bước sóng 570 nm.
3
(nm)
A
48
0
50
0
52
0
54
0
56
0
58
0
60
0
62
0
0.
3
0.
4
0.
5
0.
6
0.
7
0.
8
(1)
(2)
(3)
(4)
(5)

4
Hình 1: Phổ hấp thụ electron của các phức
1. Ho(III) - PAN - CH3COOH 3. Ho(III) - PAN - CH Cl2COOH
2. Ho(III) - PAN - CH2 ClCOOH 4. Ho(III) - PAN - C Cl3COOH
5. Ho(III) - PAN
2. Sự phụ thuộc mật độ quang của phức vào tỷ lệ Vaxêton : Vnước và thời
gian:
Kết quả sự phụ thuộc của mật độ quang phức màu Ho(III) - PAN -
CH3COOH vào tỷ lệ Vaxêton : Vnước được ghi ở bảng 1. Qua bảng 1 cho thấy tỷ lệ
phức tối ưu là Vaxêton : Vnước = 1 : 3. Các dung dịch phức đa phối tử khác cũng cho
tỷ lệ tạo phức tối ưu như vậy.
Bảng 1: Sự phụ thuộc
A vào tỷ lệ Vaxeton: Vnước của dung dịch phức Ho(III)-PAN
- CH3COOH.

5
Vaxeton: Vnước
1:10 1:9 1:8 1:6 1:4 1:3 1:2 1:1
A 0,176
0,719 0,724 0,732 0,738 0,744
0,738 0,706
Các phức đa phối tử Ho(III) - PAN - HX ổn định sau 10 phút kể từ khi pha
chế và kéo dài trong vòng 45 phút. Đây là điều kiện rất thuận lợi cho nghiên cứu
phức chất.
3. Ảnh hưởng của pH đến sự tạo phức:
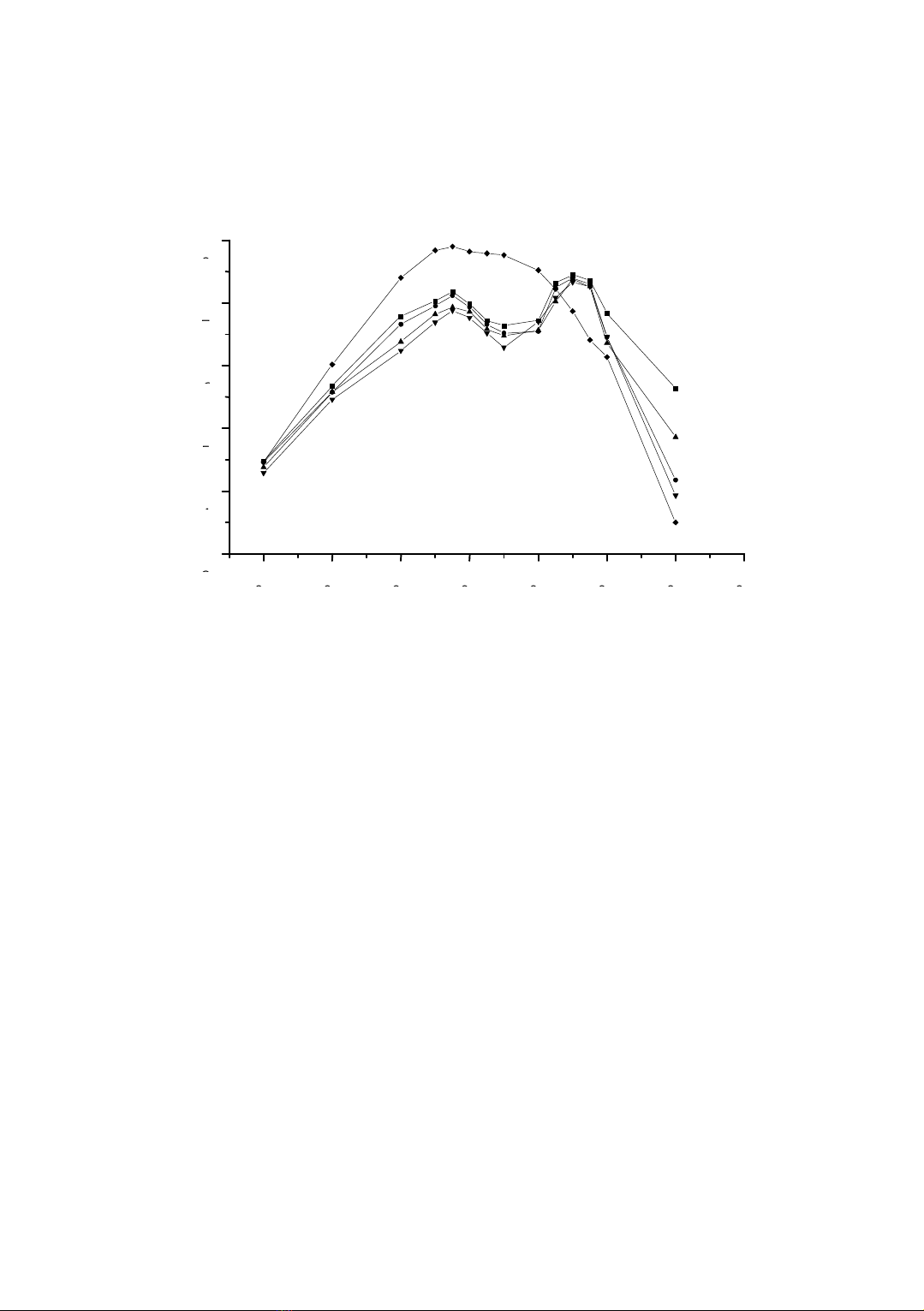
Mật độ quang của các phức đa phối tử phụ thuộc vào pH được biểu diễn
trên hình 2. Qua hình 2 cho thấy, pH tối ưu của phức Ho(III) - PAN - CH3COOH
từ 9,5 - 11; Ho(III) - PAN - CH3ClCOOH từ 9 - 11; Ho(III) - PAN - CHCl2COOH từ
8,5 - 11; Ho(III) - PAN - CCl3COOH từ 8,0 - 10,5 .








![Hình ảnh học bệnh não mạch máu nhỏ: Báo cáo [Năm]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20240705/sanhobien01/135x160/1985290001.jpg)

















