
1
MỤC LỤC
CHƯƠNG I PHƯƠNG PHÁP PHÂN TÍCH THỂ TÍCH ........................... 2
BÀI 1 XÁC ĐỊNH HÀM LƯỢNG ACID CITRIC TRONG NƯỚC TRÁI
CÂY .................................................................................................................... 2
BÀI 2 XÁC ĐỊNH HÀM LƯỢNG ASPIRIN TRONG MẪU THUỐC BẰNG
PHƯƠNG PHÁP CHUẨN ĐỘ NGƯỢC ......................................................... 6
BÀI 3 XÁC ĐỊNH HÀM LƯỢNG NƯỚC CỨNG BẰNG PHƯƠNG
PHÁP CHUẨN ĐỘ EDTA ............................................................................ 14
BÀI 4 XÁC ĐỊNH HÀM LƯỢNG CLO TRONG NƯỚC BẰNG PHƯƠNG
PHÁP CHUẨN ĐỘ KẾT TỦA ....................................................................... 18
BÀI 5 XÁC ĐỊNH HÀM LƯỢNG VITAMIN C TRONG MẪU THUỐC
BẰNG PHƯƠNG PHÁP CHUẨN ĐỘ OXI HÓA KHỬ .............................. 23
BÀI 6 XÁC ĐỊNH HÀM LƯỢNG HYPOCHLORIDE TRONG MẪU
NƯỚC TẨY RỬA BẰNG PHƯƠNG PHÁP CHUẨN ĐỘ IDOMETRIC ... 28
CHƯƠNG 2 PHƯƠNG PHÁP CHUẨN ĐỘ ĐIỆN THẾ .......................... 34
BÀI 2 XÁC ĐỊNH HÀM LƯỢNG CARBONATE TRONG MẪU BẰNG
MÁY ĐO pH ................................................................................................... 34
CHƯƠNG 3 PHÂN TÍCH TRỌNG LƯỢNG ............................................. 40
BÀI 1 XÁC ĐỊNH HÀM LƯỢNG ION SULFATE TRONG MẪU MUỐI . 40
BÀI 2 XÁC ĐỊNH HÀM LƯỢNG PHOSPHO TRONG PHÂN BÓN ..... 43
BÀI 3 XÁC ĐỊNH HÀM LƯỢNG CLO TRONG NƯỚC ......................... 45
BẰNG PHƯƠNG PHÁP KẾT TỦA ............................................................ 45
TÀI LIỆU THAM KHẢO ................................................................................ 49

2
CHƯƠNG I
PHƯƠNG PHÁP PHÂN TÍCH THỂ TÍCH
BÀI 1
XÁC ĐỊNH HÀM LƯỢNG ACID CITRIC TRONG NƯỚC TRÁI
CÂY
I. Cơ sở lý thuyết
Acid ctric khi hòa tan trong nước sẽ tạo thành triprotic acid có khả năng phân ly cho
3 proton H+. nếu cho phản ứng với một base mạnh sẽ tọ thành muối và nước theo
phản ứng:
C
H
2
C
H
2
C
COOHOH
COOH
COOH
+3NaOH C
H
2
C
H
2
C
COONaOH
COONa
COONa
+3H2O
Các sản phảm nước trái cây thị trường có thể định lượng lượng trái cây bằng cách đo
hàm lượng acid citric trong đó. Quy trình thông dụng nhất là sử dụng NaOH chuẩn
để chuẩn độ acid citric. Điểm cuối của phản ứng được đánh dấu bằng sự đổi màu của
chất chỉ thị phenolphtalein.
II. Hóa chất và dụng cụ
1. Hóa chất
- Dung dịch phenolphtalein.
- NaOH.
- Giấy đo pH.
- Mẫu nước trái cây.
2. Dụng cụ
- Beaker 100mL.
- Buret.
- Pipet 10mL.
- ống đong 50mL.
- Pipet 5mL.
- Bình định mức 100mL.
III. Thực nghiệm
1. Pha dung dịch phenolphtalein.
Cân 0.5g phenolphtalein cho vào bình định mức 100mL, thêm 50mL ethanol, định
mức tới vạch bằng nước cất. lắc đều để yên 15 phút.

3
2. Chuẩn độ dụng dịch phân tích
- Lắp đầy buret bằng dung dịch chuẩn NaOH 0.05M.
- Lấy 2mL dung dịch nước trái cây đã lọc qua giấy lọc cho vào bình định mức 50mL
đã có sẵn 25mL nước cất, sau đó định mức đến vạch.
- Lấy 10mL dung dịch nước trái cây trên bằng pipet 10mL cho vào erlen 250mL.
Thêm khoảng 30mL nước, 3 giọt phenolphtalein, khuấy đều. Kiểm tra pH dung
dịch bằng giấy đo pH.
- Chuẩn độ dung dịch phân tích với NaOH đến khi xuất hiện màu hồng bền trong
30 giây thì ngừng ghi nhận giá trị thể tích NaOH trên buret.
- Tiến hành 3 lần lấy kết quả trung bình.
3. Chuẩn hóa dung dịch NaOH
- Lắp đầy buret bằng dung dịch NaOH đã pha
- Lấy 10ml Oxalic acid 0.1N cho vào erlen 250ml thêm 3 giọt chỉ thị phenolphtalein
- Chuẩn độ dung dịch Oxalic acid 0.1N với NaOH đến khi xuất hiện màu hồng bền
trong 30 giây thì ngừng ghi nhận giá trị thể tích NaOH trên buret
IV. Kết quả
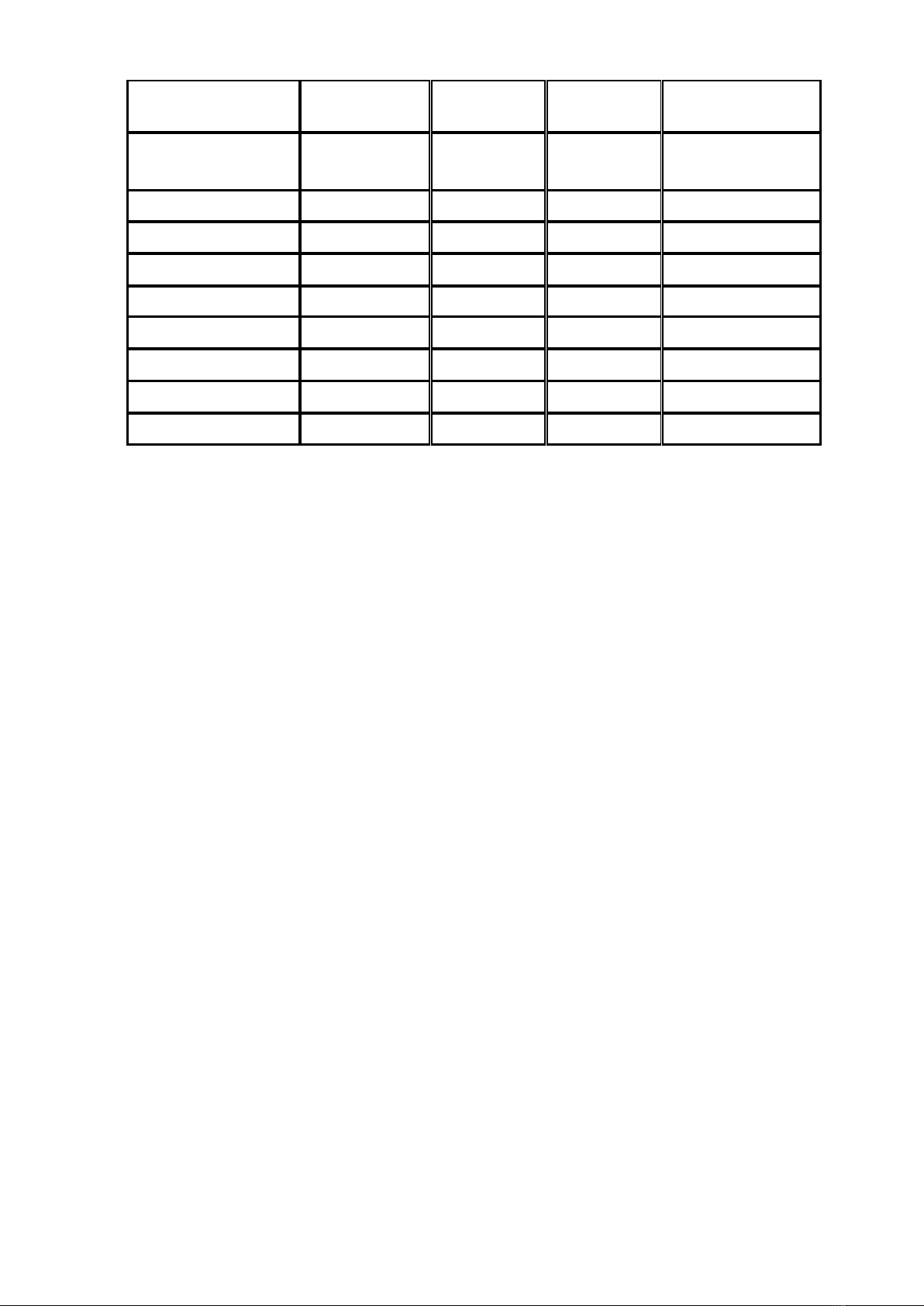
1. Nồng độ chính xác của NaOH sau khi chuẩn hóa
Số lần
V
NaOH
(ml)
V
Oxalic acid
0.05N
(ml)
1
9.7
10
2
9.8
10
3
9.9
10
TB
9.8
TB: 10
Từ Vtb của NaOH qua 3 lần chuẩn độ lập lại:
0.05 10 0.051 0.051
9.8
NaOH
x
C NM= = =
2. Thể tích và số mol của NaOH sử dụng
Số lần
V
NaOH
(ml)
n
NaOH
(ml)
1
8.5
4.335 x 10-4
2
8.6
4.386 x 10-4
3
8.8
4.488 x 10-4
TB
8.63
4.4 x 10-4
4
3. Số mol và khối lượng của Acid citric sử dụng, %(m/V) của mẫu:
Từ phương trình:
Ta thấy acid citric phân ly ra 3 H+ nên số Z sẽ là 3 và nồng độ CM của acid citric được
xác định bằng Vtb của NaOH chuẩn độ và số Z của acid citric trong phương trình,
sau đó nhân với hệ số pha loãng khi pha loãng 2ml nước trái cây thành 50ml.
8.63 0.051 25 0.367
10 3
M acidcirric
x
C xM
x
= =
- Số mol acid citric:
nacid citric = CM x V = 0.367 x 0.002 = 7.34 x 10-4 mol
- Khối lượng acid citric :
Macid citric = 0.367 x 0.002 x 192 = 0.14g
- % (m/V) acid trong mẫu:
C% =
0.14 100% 7%
2x=
V. Câu hỏi (bài tập) củng cố:
1. Trình bày quy trình xác định acid citric trong mẫu nước trái cây.
- Lắp đầy buret bằng dung dịch chuẩn NaOH 0.05M.
- Lấy 10mL dung dịch nước trái cây bằng ống đong cho vào erlen 250mL. Thêm
khoảng 30mL nước, 3 giọt phenolphtalein, khuấy đều. Kiểm tra pH dung dịch
bằng giấy đo pH.
- Chuẩn độ dung dịch phân tích với NaOH đến khi xuất hiện màu hồng bề trong
30 giây thì ngừng ghi nhận giá trị thể tích NaOH trên buret.
- Tiến hành 3 lần lấy kết quả trung bình.
2. Tại sao phải sử dụng phenolphtalein làm chất chỉ thị? Có thể sử dụng hóa
chất khác được không?
C
H2C
H2C
COOHOH
COOH
COOH
+3NaOH C
H2C
H2C
COONaOH
COONa
COONa
+3H
2
O
5
Một số chất chỉ thị acid base thường dùng:
Tên thường dùng
Dung môi
Màu dạng
axít
Màu dạng
bazơ
Khoảng pH đổi
màu
Metyldacam
(Heliantin)
Nước
Đỏ hồng
vàng
3,1 – 4,4
Bromphenol xanh
Nước
Vàng
Nâu tím
3,0 – 4,6
Brom crezol lục
Nước
Vàng
Xanh
3,8 – 5,4
Metyl đỏ
Nước
Đỏ hồng
Vàng
4,4 – 6,2
Brom thymol xanh
Nước
Vàng
Xanh
6,2 – 7,6
Phenol đỏ
Nước
Vàng
Đỏ
6,4 – 8,0
Thymol xanh
Nước
Vàng
Xanh
8,0 – 9,6
Phenolphtalein
Rượu 70%
Không màu
Đỏ
8,0 – 9,8
Thymolphtalein
Rượu 90%
Không màu
Xanh
9,4 – 10,6
http://hocdethi.blogspot.com/2013/05/phuong-phap-chuan-o-axit-bazo.html
Vì khoảng phenolphtalein bắt đầu chuyển màu hồng từ điểm pH = 8 là điểm bắt đầu
chuyển màu phù hợp với phương pháp chuẩn độ acid base, đối với phương pháp
chuẩn độ acid yếu bằng base mạnh thì điểm tương đương là môi trường base yếu
nên pH sẽ gần bằng 8 nên sử dụng phenolphtalein là phù hợp nhất.
Ngoài ra có thể sử dụng methyl đỏ để chuẩn độ, trong phương pháp này thì NaOH
sẽ nằm dưới erlen, acid citric sẽ được đổ trên buret để chuẩn độ cho NaOH với điểm
pH = 6.2 thì dung dịch sẽ chuyển từ vàng sang màu đỏ hồng.




![Báo cáo thực hành hóa lý [năm] chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2019/20191025/codon2727/135x160/941571998475.jpg)

![Lược đồ Hocne: [Thông tin chi tiết/Hướng dẫn sử dụng/Cập nhật mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2018/20180518/yeuanhcanhnhieu/135x160/2951526625650.jpg)


![Phương pháp cân bằng tích: Chuyên đề [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20160326/vuhoangxuanthanh/135x160/391458984677.jpg)















