2/20/2014
1
Boä moân Hoùa Phaân Tích – Kieåm Nghieäm
Khoa Döôïc – Ñaïi hoïc Y Döôïc TPHCM
PHÖÔNG PHAÙP PHAÂN TÍCH ÑIEÄN HOAÙ
PHAÂN TÍCH ÑIEÄN HOAÙ
Phân tích điện hóa là phương pháp phân tích
dựa trên dòng chuyển động của các phần tử
mang điện tích (electron, ion âm, ion dương)
trong dung dịch hay trong phản ứng hóa học
Sự biến đổi của 3 đại lượng E, I và R trong
phản ứng hoá học cũng tuân theo nguyên tắc
của định luật Ohm:
E = i.R
Định lượng các chất tham gia và hình thành
trong phản ứng qua việc đo lường các đại
lượng (E, I và R) trong quá trình phản ứng
PHAÂN TÍCH ÑIEÄN HOAÙ
Đặc điểm chung của phương pháp này là bất
kỳ một dụng cụ phân tích điện hóa nào cũng
gồm có:
- điện cực nhúng trong dung dịch phân tích,
- dụng cụ đo điện thế hay cường độ dòng,
- máy vẽ đồ thị.
PHAÂN TÍCH ÑIEÄN HOAÙ
• Phương pháp đo độ dẫn điện
• Phương pháp phân tích đo điện thế
• Phương pháp phân tích volt-ampe
• Phương pháp điện phân và đo điện lượng

2/20/2014
2
PHÖÔNG PHAÙP PHAÂN TÍCH ÑIEÄN THEÁ
1/ Theá ñieän cöïc:
1.1. Phaûn öùng oxy hoùa khöû
Phản ứng c sự di chuyển điện tử từ thành phần
này sang thành phần kia trong phản ứng.
Ox1 + ne Kh1
Kh2 Ox2 + ne
Ox1 + Kh2 Ox2 + Kh1
Điện cực: (Half cell – bán pin) là một thanh kim loại
nhúng vào một dung dịch điện ly thể hiện bán phản
ứng oxy ha khử.
1/ Theá ñieän cöïc:
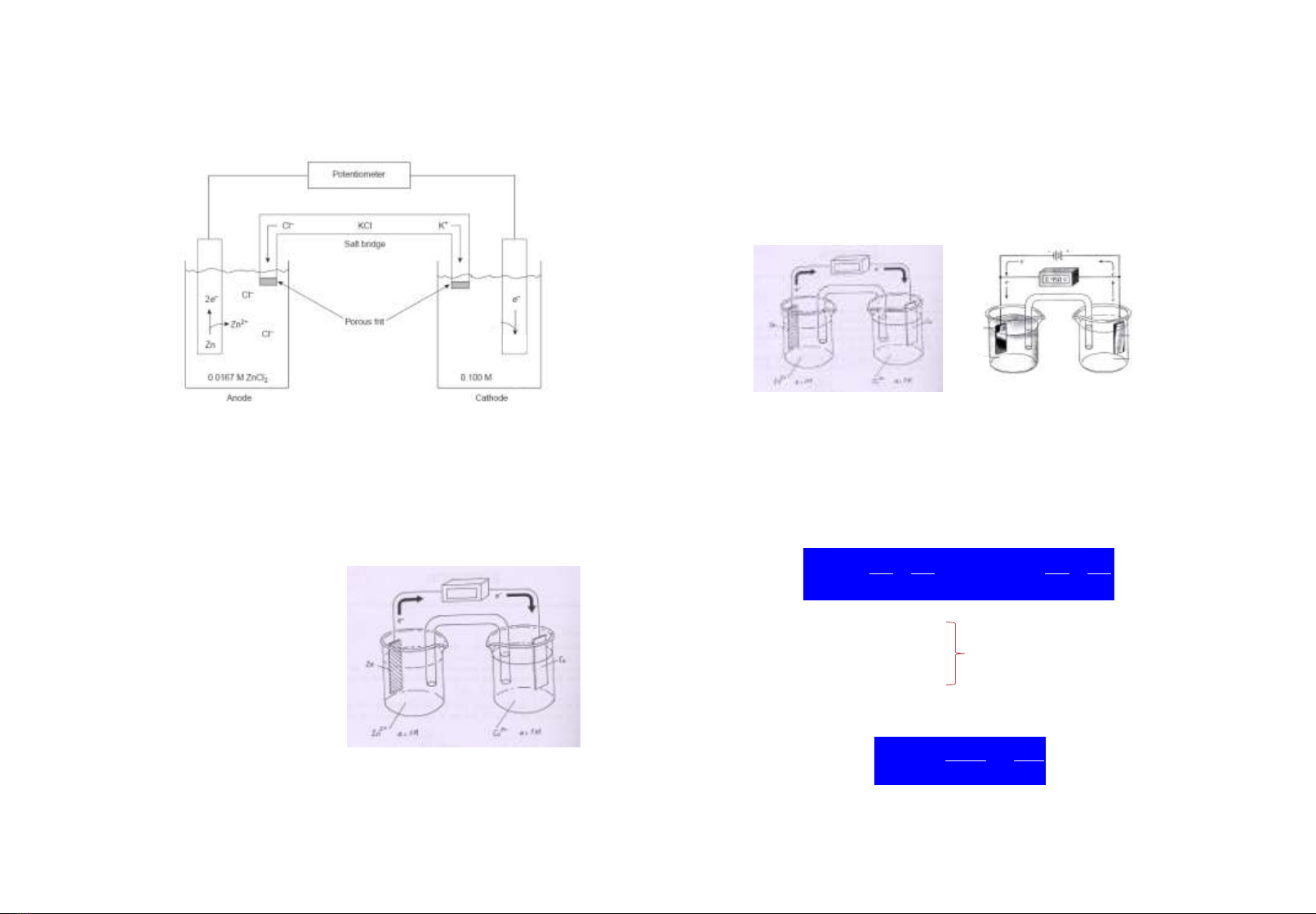
1.2. Pin ñieän (teá baøo ñieän hoùa) = Ñieän cöïc + caàu muoái
- Anod laø ñieän cöïc maø ôû ñoù xaûy ra phaûn öùng oxy hoùa
(hay phaûn öùng nhöôøng ñieän töû)
- Cathod laø ñieän cöïc maø ôû ñoù xaûy ra phaûn öùng khöû
(hay phaûn öùng nhaän ñieän töû)
Zn0 Zn+2 + 2 e- (anod)
Cu+2 + 2e- Cu0 (cathod)
Zno + Cu+2 Zn+2 + Cuo
Caàu muoái: laø moät oáng thuûy
tinh chöùa dung dòch muoái
daãn ñieän (KCl, NH4Cl) döôùi
daïng gel
1/ Theá ñieän cöïc:
1.2. Pin ñieän (teá baøo ñieän hoùa) = Ñieän cöïc + caàu muoái
Zn0 Zn+2 + 2 e- (anod)
Cu+2 + 2e- Cu0 (cathod)
1/ Theá ñieän cöïc:
1.1. Phaûn öùng oxy hoùa khöû
Zn0 Zn+2 + 2 e- (anod)
Cu+2 + 2e- Cu0 (cathod)
Zno + Cu+2 Zn+2 + Cuo
2/20/2014
3
1.2. Pin ñieän (teá baøo ñieän hoùa):
Caùc giai ñoïan cuûa phaûn öùng ñieän hoùa:
SO42-
Cu2+
CuSO4
Cu
1.2. Pin ñieän (teá baøo ñieän hoùa):
Pin GALVANIC:
taïo ra ñieän naêng, töï hoaït ñoäng, Anod: - (Zn) cathod:+(Cu)
Pin ÑIEÄN LY:
caàn cung caáp naêng löôïng ñieän töø beân ngoaøi, Anod + (Cu);
cathod: - (Zn)
Pin GALVANIC Pin ÑIEÄN LY
Anod
Cu
Zn+2
Cathod
Zn
Cu+2
Zn+2 + Cu Zn + Cu+2
1.2. Pin ñieän (teá baøo ñieän hoùa):
Qui öôùc caùch vieát maïch ñieän hoùa:
- Anod vaø caùc thoâng soá
vieát beân traùi caàu muoái.
- Cathod vaø caùc thoâng soá
vieát beân phaûi caàu muoái.
- Ranh giôùi hai pha xuaát
hieän theá kyù hieäu: hay /.
- Caàu muoái kyù hieäu baèng
|| hay //
ZnZn+2 (1,0 M) || Cu+2 (1,0 M)Cu
ox
kh
o
kh
ox
o
a
a
nF
RT
EEhay
a
a
nF
RT
EE lnln
1.3. Phöông trình Nernst:
Walther Hermann Nernst (Ñöùc, Nobel 1920)
][
][
log
059,0
kh
ox
n
EE o
ÔÛ nhieät ñoä 25 oC:
T = 298 oK,
R = 8,3144 J.oK-1.mol-1,
F = 96.500 Coulomb.mol-1
RT/F = 298.8,3144/96500
= 0,025675
Chuyeån ln sang log (nhaân 2,303): 2,303 (RT/F) = 0,05916
2/20/2014
4
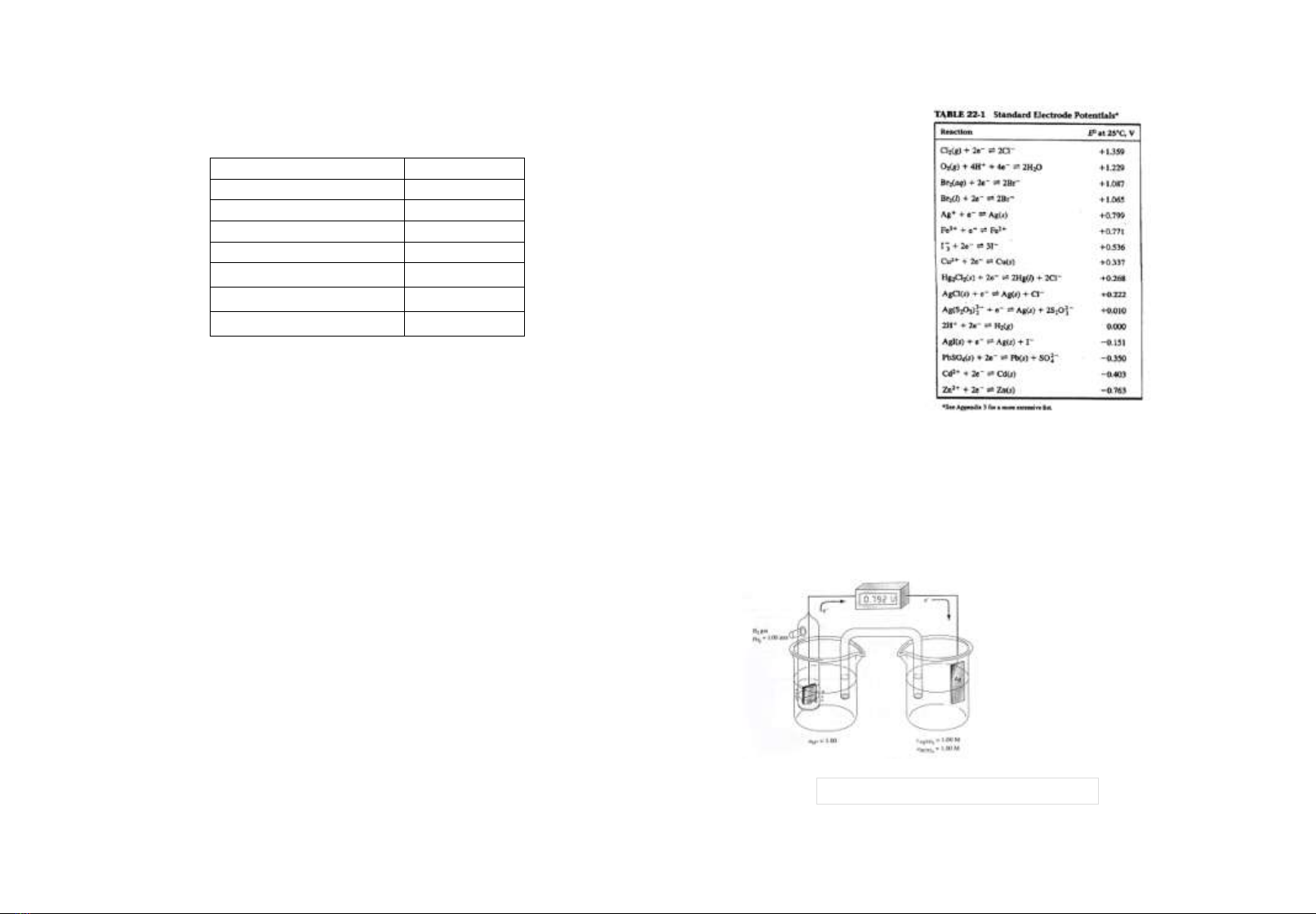
Phaûn öùng Eo (V, 25oC)
Cl2 + 2e 2Cl- + 1,359
O2 + 4H+ + 4e 2 H2O + 1,229
Ag0 Ag++ e + 0,799
2 H+ + 2e H2 0,000
Ag(CN)2- + e Ag +2CN- - 0,290
Cd+2 + 2e Cd - 0,403
Zn+2 + 2e Zn - 0,763
Theá cuûa ñieän cöïc Hydro ôû ñieàu kieän chuaån laø 0,000 V.
Theá cuûa caùc ñieän cöïc khaùc döïa treân giaù trò naøy ñeå so
saùnh vôùi nhau
Phöông trình Nernst:
Walther Hermann Nernst (Ñöùc, Nobel 1920)
Theá cuûa ñieän cöïc
Hydro ôû ñieàu kieän
chuaån laø 0,000 V.
Theá cuûa caùc ñieän
cöïc khaùc döïa treân
giaù trò naøy ñeå so
saùnh vôùi nhau
Không thể xác định thế tuyệt đối của một điện cực,
người ta chỉ có thể xác định thế của điện cực một
cách tương đối, tức so sánh hiệu điện thế giữa hai
điện cực – một điện cực có thế âm hơn (hoặc dương
hơn) so với điện cực kia
Ghép điện cực (half cell) cần xác định với điện cực
H2 (có thế bằng 0 trong điều kiện chuẩn 25 oC, PH2 =
1 atm) để tạo một pin galvanic. Dấu của thế điện cực
là âm (điện cực đ là anod) hay dương (điện cực đ
là cathod) so với điện cực Hydrogen trong mạch
Galvanic
XAÙC ÑÒNH THEÁ ÑIEÄN CÖÏC
Phöông trình Nernst:
Caùch xaùc ñònh theá ñieän cöïc
ĐC Hydrogen là anod,
ĐC Bạc là cathod,
EAg = + 0,792V
EPIN = Ecathod - Eanod = Ephải - Etrái

2/20/2014
5
Phöông trình Nernst:
Caùch xaùc ñònh theá ñieän cöïc
EPin= Ecathod - Eanod = Ephải - Etrái
Tính điện thế của pin galvanic:
Cu I Cu2+ (0,0200 M) II Ag+ (0,0200 M) I Ag
Ag+ + e- Ag(s) E0 = 0,799 V
Cu2+ + 2e- Cu(s) E0 = 0,337 V
EAg+/Ag = 0,799 - 0,0592.log 1/0,02 = 0,6984 V
ECu2+/Cu = 0,337 - 0,0592/2.log 1/0,02= 0,2867 V
Ecell = Ephải - Etrái = EAg+/Ag - ECu+/Cu = 0,6984 - 0,2867 = 0,412 V
Phöông trình Nernst:
Aûnh höôûng cuûa pH moâi tröôøng (noàng ñoä acid):
- Khi [Cr2O7-2 ] = [Cr+3], ở pH = 2 tức [H+] = 10-2
Cr2O7-2 +14H+ + 6e 2Cr+3 + H2O
23
146
0
][
]][[
lg
6
05916,0
3
6
3
6
Cr
HCr
EE
Cr
Cr
Cr
Cr
vEE
Cr
Cr 054,1)142(
6
05916,0
33,1)10lg(
6
05916,0 1420'
0
3
7
- Ở pH = 3 tức [H+] = 10-3
vEE
Cr
Cr 916,0)143(
6
05916,0
33,1)10lg(
6
05916,0 1430'
0
3
7
Phöông trình Nernst:
Aûnh höôûng cuûa phaûn öùng keát tuûa:
Aûnh höôûng cuûa phaûn öùng taïo phöùc:
Phương trình Nernst:
Cách xác định thế điện cực
Thế điện cực theo phương trình Nernst phụ
thuộc vào số mol của chất tham gia bán phản
ứng oxy ha khử:
Fe3+ + e- Fe2+ E0 = + 0,771 V
5Fe3+ + 5e- 5Fe2+ E0 = + 0,771 V
52
53
2
3
][
][
log
5
0591,0
][
][
log
1
0591,0
Fe
Fe
Fe
Fe




![Báo cáo thực hành hóa lý [năm] chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2019/20191025/codon2727/135x160/941571998475.jpg)
![Lược đồ Hocne: [Thông tin chi tiết/Hướng dẫn sử dụng/Cập nhật mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2018/20180518/yeuanhcanhnhieu/135x160/2951526625650.jpg)



![Phương pháp cân bằng tích: Chuyên đề [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20160326/vuhoangxuanthanh/135x160/391458984677.jpg)















