
164 Giaùo Trình Vaät Lyù Ñaïi Cöông – Taäp I: Cô – Nhieät - Ñieän
Chương 7
THUYẾT ĐỘNG HỌC PHÂN TỬ
VÀ CHẤT KHÍ LÍ TƯỞNG
§7.1 NỘI DUNG CỦA THUYẾT ĐỘNG HỌC PHÂN TỬ
Thuyết Động Học Phân Tử là một trong những thuyết Vật Lý ra đời sớm nhất.
Nó kế thừa những quan điểm cổ đại về cấu tạo vật chất và những kết qủa của cuộc đấu
tranh kéo dài nhiều thế kỷ giữa các tư tưởng đối lập nhau về bản chất của nhiệt
Nội dung cơ bản của Thuyết Động Học Phân Tử có thể tóm tắt bằng các quan
điểm sau:
- Vật chất được cấu tạo gián đoạn từ những hạt rất nhỏ, gọi là phân tử.
- Các phân tử chuyển động hỗn loạn không ngừng.
- Các phân tử tương tác với nhau bằng các lực hút và lực đẩy
- Chuyển động và tương tác của các phân tử tuân theo các định luật cơ học
của Newton
Thuyết Động Học Phân Tử không những giải thích được các hiện tượng nhiệt
của các chất như: khuếch tán, truyền nhiệt, dẫn nhiệt, bay hơi, ngưng tụ, … , mà còn là
cơ sở để nghiên cứu về các quá trình biến đổi trạng thái của khí.
§7.2 PHƯƠNG TRÌNH CƠ BẢN CỦA THUYẾT ĐỘNG HỌC PHÂN TỬ
1 – Mẫu khí lý tưởng:
Để dễ dàng vận dụng thuyết Động Học Phân Tử vào việc khảo sát định lượng
các tính chất của chất khí, ta bỏ qua những yếu tố phụ không ảnh hưởng đến những
tính chất cơ bản của khí. Từ đó, xây dựng nên mẫu khí lý tưởng, bao gồm các đặc tính
sau:
- Một khối khí bất kì cũng gồm vô số các phân tử. Các phân tử có kích thước rất
nhỏ so với khoảng cách giữa chúng, và được coi là những chất điểm.
- Các phân tử khí luôn chuyển động hỗn loạn không ngừng và chỉ tương tác với
nhau khi va chạm vào nhau.
- Va chạm giữa các phân tử khí với nhau hay với thành bình là hoàn toàn đàn hồi.
Chöông 7: TÑHPT VAØ CHAÁT KHÍ LÍ TÖÔÛNG 165
Trên thực tế không có khí lý tưởng. Tuy nhiên, trong phạm vi gần đúng, các
kết qủa rút ra đối với khí lý tưởng cũng áp dụng được cho khí thực. Trong giáo trình
này, ta chỉ nghiên cứu về khí lý tưởng.
2 – Áp suất khí khí lí tưởng:
Các phân tử khí chuyển động hỗn loạn không ngừng va vào thành bình hoặc
vào bề mặt ∆S bất kì nằm trong khối khí, tạo nên áp suất. Chuyển động của các phân
tử càng nhanh, tức động năng càng lớn, thì đập vào bình với áp lực càng lớn, gây ra áp
suất càng lớn. Ngoài ra, mật độ các phân tử khí càng lớn thì khả năng va chạm với
thành bình càng cao, suy ra áp suất càng lớn.
Vậy: áp suất của khí có liên quan đến động năng của các phân tử khí và mật độ khí.
Hệ thức liên hệ giữa áp suất, mật độ và động năng của các phân tử khí, gọi là phương
trình cơ bản của Thuyết Động Học Phân Tử.
3 – Thiết lập phương trình:
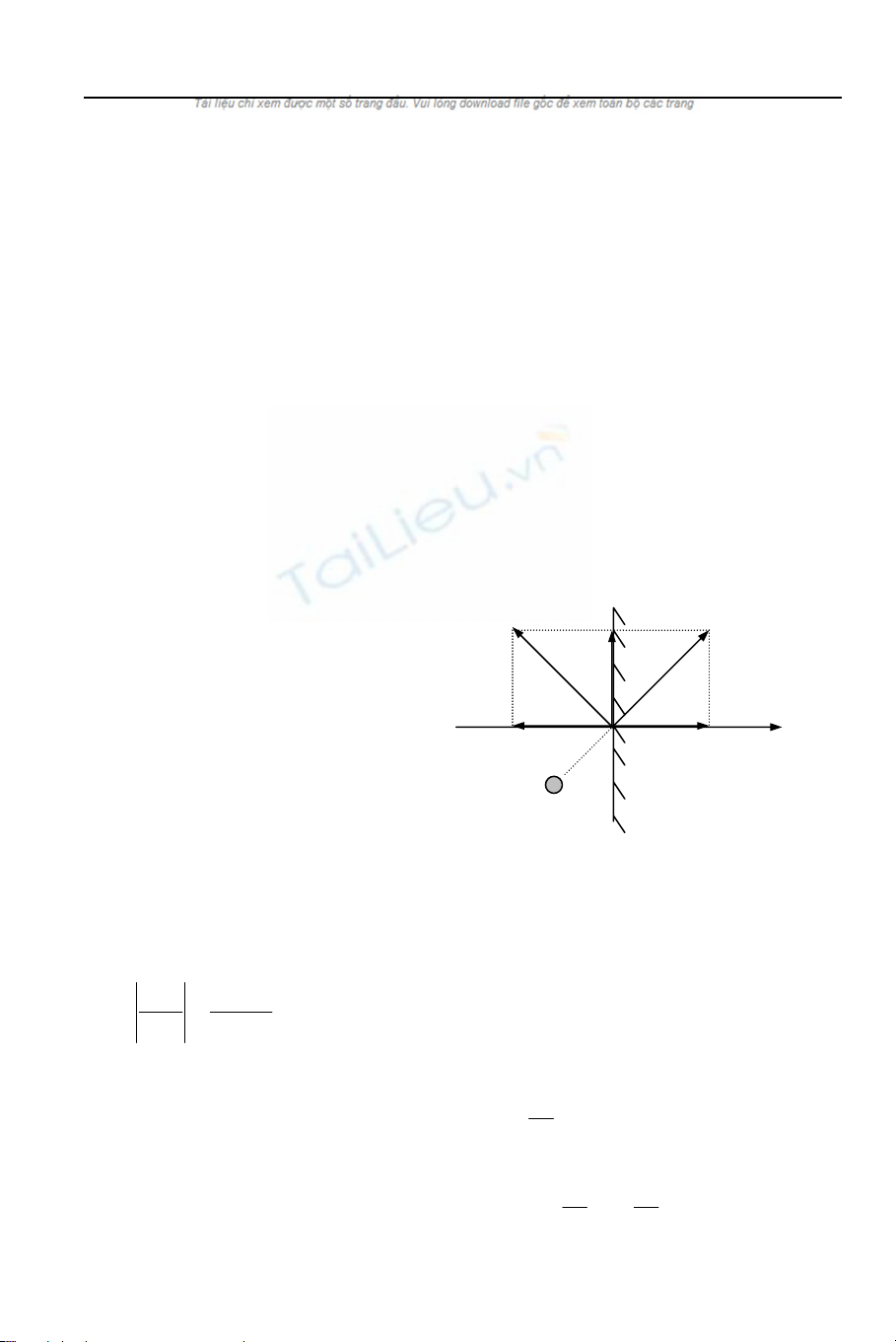
Xét một phân tử khí chuyển
động với vận tốc đến va vào thành
bình. Do va chạm là đàn hồi, nên sau
va chạm, vận tốc của nó là đối
xứng với qua mặt tiếp xúc (thành
phần tiếp tuyến không đổi). Độ biến
thiên động lượng của phân tử khí đó
là:
→
i
v
→
'v i
ixixix
→
i
v
m
→
ix
v
→
ix
'v
→
i
v
→
iy
v
O
→
i
'v
x
Hình 7.1: Va chạm của 1 phân tử
khí với thành bình
d p
→
→
→
→
→
−=−= i
'
ii
'
ii vmvmpp
Độ biến thiên động lượng theo phương Ox: dp )v'v(m
−
=
= 2m . Suy ra,
áp lực vuông góc mà phân tử khí này tác dụng lên thành bình là:
ix
v
dt
mv2
dt
dp
fixix
ix == .
Gọi ni là nồng độ (mật độ) các phân tử khí chuyển động theo phương Ox với vận tốc
vix thì nồng độ các phân tử đi theo chiều dường là 2
ni . Suy ra, số hạt Ni chuyển động
với vận tốc vix đến đập vuông góc vào thành bình trong thời gian dt phải nằm trong
hình trụ có đáy là ∆S, chiều cao là vix.dt. Ta có: dtv.S
2
n
V
2
n
Nix
ii
i∆== .
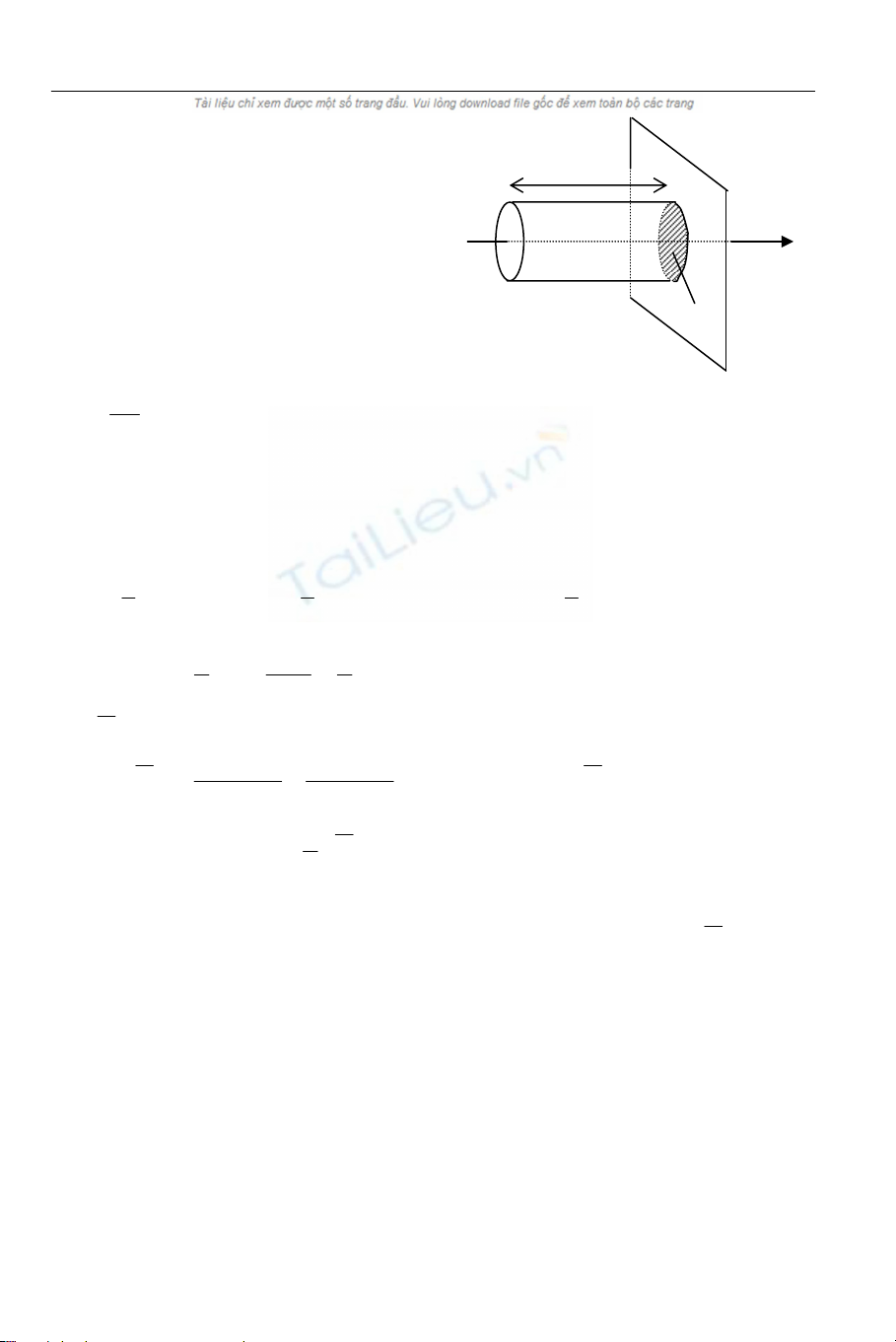
166 Giaùo Trình Vaät Lyù Ñaïi Cöông – Taäp I: Cô – Nhieät - Ñieän
⇒ Áp lực do các phân tử này tác dụng vào
thành bình là:
2
ixiixiix v.Sn.mfNF ∆==
⇒ Áp lực của tất cả các phân tử khí chuyển
động với các vận tốc vx khác nhau đến va
vào thành bình trong thời gian dt là:
∑∑
∆== 2
ixiixx v.n.mSFF
∆
S
Vix. dt
x
⇒ Áp suất khí gây ra theo hướng Ox là:
∑
=
∆
=2
ixi
x
xv.n.m
S
F
p
Tương tự, ta cũng có áp suất theo các
hướng Oy, Oz:
∑
∑
== 2
iziz
2
iyiy vn.mp;v.n.mp
Hình 7.2: Trong thời gian dt, các
ân tử có vận tốc vph h
ix nằm trong hìn
trụ này sẽ va vào diện tích
∆
S
Do tính hỗn loạn (không có hướng ưu tiên), nên px = py = pz = p
⇒ ∑∑ =++=++= 2
ii
2
iz
2
iy
2
ixizyx vn.m
3
1
)vvv(n.m
3
1
)ppp(
3
1
p
⇒ ∑∑
== ñii
2
i
iwn
3
2
2
mv
n
3
2
p
Gọi ñ
w là động năng trung bình của các phân tử khí, ta có:
ñ
w = ñ
ñ
ññ wnwn
n
wn
n
wn
ii
ii
i
ii =⇒= ∑
∑
∑
∑
Vậy: ñ
wn
3
2
p= (7.1)
Trong đó: n = là nộng độ (hay mật độ) phân tử khí – chính là số phân tử khí
trong một đơn vị thể tích. Trong hệ SI, nồng độ khí có đơn vị (m
∑i
n
– 3); ñ
w là động
năng trung bình của các phân tử khí; p là áp suất của khí.
Phương trình (7.1) là phương trình cơ bản của Thuyết Động Học Phân Tử. Nó
cho thấy mối quan hệ giữa áp suất (đại lượng vĩ mô) – đặc trưng cho tác dụng tập thể
của các phân tử – với mật độ và động năng trung bình của các phân tử khí (các đại
lượng vi mô) – đặc trưng cho phân tử và chuyển động của phân tử.
Phương trình (7.1) chỉ rõ cơ chế vi mô của áp suất chất khí tác dụng lên thành
bình và phản ánh một cách tường minh các quan điểm cơ bản của Thuyết Động Học
Phân Tử.
Phương trình (7.1) có tính thống kê. Các đại lượng trong (7.1) là các đại lượng
thống kê. Ta chỉ có thể nói tới áp suất và động năng trung bình của một tập hợp rất lớn
các phân tử; không thể nói tới áp suất và động năng của một hoặc một số ít phân tử.

Chöông 7: TÑHPT VAØ CHAÁT KHÍ LÍ TÖÔÛNG 167
§7.3 NHIỆT ĐỘ – NHIỆT GIAI
Nhiệt độ của một vật cho ta cảm giác về mức độ nóng lạnh của vật đó. Cụ thể
nếu nhiệt độ của vật A lớn hơn nhiệt độ của vật B thì ta nói vật A “nóng“ hơn vật B,
hay vật B “lạnh” hơn vật A . Tuy nhiên, điều đó chỉ mang tính tương đối, vì cảm giác
nóng, lạnh phụ thuộc vào từng người và từng trường hợp cụ thể (nghĩa là mang tính
chủ quan). Tính chất nóng, lạnh mà ta cảm nhận được ở vật liên quan đến năng lượng
chuyển động nhiệt của các phân tử. Vì thế, nhiệt độ được định nghĩa một chách chính
xác như sau:
Nhiệt độ là đại lượng vật lý, đặc trưng cho tính chất vĩ mô của vật (hay hệ
vật), thể hiện mức độ nhanh, chậm của chuyển động hỗn loạn của các phân tử của vật
(hay hệ vật) đó.
Nhiệt độ liên quan đến năng lượng chuyển động nhiệt (động năng) của các
phân tử. Tuy nhiên, trên thực tế ta không thể dùng đơn vị năng lượng để đo nhiệt độ
vì: ta không thể đo trực tiếp năng lượng chuyển động nhiệt, hơn nữa năng lượng ấy lại
rất nhỏ. Vì thế ta dùng đơn vị của nhiệt độ là độ (o). Tùy theo cách chia độ mà ta có
các nhiệt giai khác nhau:
• Nhiệt giai Celsius (nhiệt giai bách phân): kí hiệu là oC. Trong nhiệt giai này,
người ta chọn điểm tan của nước đá và điểm sôi của nước (ở áp suất 1 atm) là
0oC và 100oC. Trong khoảng này, chia làm 100 phần đều nhau, mỗi phần gọi
là 1oC.
• Nhiệt giai Fahrenheit: kí hiệu là oF. Trong nhiệt giai này, người ta chọn điểm
tan của nước đá và điểm sôi của nước (ở áp suất 1 atm) là 32oF và 212oF.
Trong khoảng này chia làm 180 phần đều nhau, mỗi phần là 1oF. Ta có hệ
thức liên hệ giữa nhiệt giai Celsius và nhiệt giai Fahrenheit:
180
32Ft
100
Ct oo −
= (7.2)
Suy ra: oo oo
59
t C (t F 32) hay t F (t C 32)
95
=− =+
(7.3)
• Nhiệt giai Kelvin (nhiệt giai Quốc tế): kí hiệu là K (thay vì oK) và được định
nghĩa từ biểu thức: nkTphayw
3
2
kT == ñ (7.4)
trong đó T là nhiệt độ của vật, đơn vị đo là kelvin (K); k = 1,38.10 – 23 (J/K) là
hằng số Boltzmann.
Ta có hệ thức liên lạc giữa nhiệt giai Kelvin và nhiệt giai bách phân là:
T = toC + 273,15 (7.5)
Với định nghĩa (7.4), khi T = 0 thì ñ
w = 0. Điều này chứng tỏ trên thực tế
không bao giờ đạt đến không độ kelvin, vì muốn vậy, các phân tử khí phải đứng yên,

168 Giaùo Trình Vaät Lyù Ñaïi Cöông – Taäp I: Cô – Nhieät - Ñieän
không còn chuyển động nhiệt hỗn loạn nữa - mâu thuẫn với thuyết động học phân tử.
Chính vì vậy 0 (K) được gọi là độ không tuyệt đối và nhiệt giai Kelvin còn gọi là nhiệt
giai tuyệt đối.
Phương trình p = nkT cũng là dạng thứ hai của phương trình cơ bản của thuyết
động học phân tử.
§7.4 HỆ QỦA CỦA THUYẾT ĐỘNG HỌC PHÂN TỬ
Thuyết động học phân tử cho biết bản chất của nhiệt chính là sự chuyển động
hỗn loạn của các phân tử, đánh đổ hoàn toàn các quan điểm về chất nhiệt trước đó.
Nó giải thích thoả đáng mọi hiện tượng và tính chất nhiệt của các chất. Từ phương
trình cơ bản (7.1), ta tìm được phương trình trạng thái khí lý tưởng, kiểm nghiệm lại
các định luật thực nghiệm về chất khí trước đó.
1 – Phương trình trạng thái khí lý tưởng:
Trạng thái của một hệ vật lý được mô tả bởi các thông số – gọi là thông số
trạng thái. Thông số nào đặc trưng cho tính chất vi mô của hệ thì ta gọi đó là thông số
vi mô; thông số nào đặc trưng cho tính chất vĩ mô của hệ thì ta gọi đó là thông số vĩ
mô.
Trạng thái của một khối khí lý tưởng có thể được mô tả bởi các thông số vĩ
mô: nhiệt độ T, áp suất p và thể tích V. Phương trình diễn tả mối quan hệ giữa các
thông số đó, được gọi là phương trình trạng thái khí lý tưởng. Ta có thể tìm được mối
quan hệ này từ phương trình cơ bản của thuyết động học phân tử (7.1).
Thật vậy: Nếu gọi n là nồng độ (mật độ) phân tử khí thì số phân tử khí chứa trong thể
tích V là: N = nV . Từ (7.4) suy ra : p.V = nkT.V = NkT = kTN
N
N
A
A
với NA là số phân tử chưá trong một mol khí (NA = 6,02.1023 mol – 1 do nhà Bác học
Avôgađrô xác lập nên được gọi là số Avôgađro); µ
=m
N
N
A
= số mol khí.
Vậy : pV = RT
m
µ (7.6)
trong đó, R là hằng số khí lý tưởng:
R = k.NA = 1,38.10 – 23 .6,02.10 – 23 = 8,31 (J.mol – 1.K – 1)
= 0,082 (atm.lít.mol – 1 .K – 1) = 0,084 (at.lít.mol – 1 .K – 1).
Phương trình (7.6) được gọi là phương trình Mendeleev – Clapeyron. Đó chính là
phương trình trạng thái của một khối khí lí tưởng bất kỳ.
Đối với một khối khí xác định (m = const), ta có: T
pV = const (7.7)








![Đề cương Cơ – Nhiệt [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2021/20211102/badao722000/135x160/831635837392.jpg)









![Giáo trình Vật lý đại cương A2 [Chuẩn Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2021/20210325/kethamoi11/135x160/2068625488.jpg)




![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)










![Phiếu bài tập cuối tuần Tiếng Việt 1 tuần 2 đề 2: [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250728/thanhha01/135x160/42951755577464.jpg)

