
http://www.ebook.edu.vn
241
Au(III)
pH 3.0,
50%
alcohol, pH
3,0
1 : 2
1 : 2
545
545
–
15,0
nước
–
không sai số với EDTA
Hg(II)
pH 3,2, 20-
60%
alcohol
1 : 3 560 11,7 nước EDTA được sử dụng
như là tác nhân bảo vệ
Hg(II)
pH 5,8,
30% n–
propanol
1 : 1 560 15,1 nước
0,007–1,5ppm, độ chọn
lọc cao với Hg, Ag,
Au(III), Pb(II), và
Sn(II) ảnh hưởng
Hg(II) pH 3,2 1 : 3 550 8,8 Iso–
AmOH –
Pd(II) pH 3,0 1 : 4 520 21,2 nước –
Pd(II) pH 3,0 1 : 4 520 16,0 Iso–
AmOH
EDTA được sử dụng
như là tác nhân bảo vệ
Pd(II) pH 2,8 520 13,0 n–
BuOH
Ag, Au, Hg, Pt, Rh, Ru,
và TI ảnh hưởng
CHƯƠNG X: THUỐC THỬ KHÔNG VÒNG
X.1. TRI-N-BULTYL PHOSPHATE
1.Danh pháp
TBP.
2.Nguồn gốc và phương pháp tổng hợp
Trong công nghiệp, TBP là chất dễ tìm.
TBP được tổng hợp từ các phản ứng giữa n–butanol với POCl3.
3. Ứng dụng trong phân tích
TBP được sử dụng rộng rãi như là một thuốc thử dung môi để chiết tách các ion
kim loại đa hoá trị.
4.Tính chất của thuốc thử
Thuốc thử organophosphorous có thể được xem như là các dẫn xuất của acid
H3PO4.
TBP lần đầu tiên được biết đến vào năm 1949 như là thuốc thử dung môi để chiết
các ion kim loại Ce, Th, và U từ dung dịch acid nitric, một số loại thuốc thử
organophosphorous còn được dùng để sử dụng như là tác nhân chiết. Việc chiết các ion
kim loại với thuốc thử phosphorous dựa trên việc tạo thành muối solvate như
CTPT: C12H27O4 P
KLPT: 266,32
CH3(CH2)3OPO
CH3(CH2)3O
CH3(CH2)3O

http://www.ebook.edu.vn
242
UO2(NO3)2(TBP)2 thông qua nhóm P=O.
Cấu trúc TBP thay đổi từ (1) đến (4) là kết quả gia tăng sự phân cực của nhóm
P=O, làm gia tăng khả năng chiết. TOPO (4) là thuốc thử rất ảnh hưởng đến việc chiết
trong nhóm này.
Sự thuỷ phân trialkylphosphate (1) cho ra monobasic diester (5) và dibasic
monoester (6), những chất này có nhiều ứng dụng quan trọng trong hoá phân tích.Ví
dụ: di(2–ethylhexyl) phosphoric acid (HDEHP) được dùng nhiều làm thuốc thử để
chiết các cation.
Theo đó, TBP, HDEHP và TOPO sẽ được xử lý tách riêng.
Tính chất vật lý của TBP:
TBP là chất lỏng, sệt, không màu; nhiệt độ sôi: 152oC – 154oC; d4: 0,975;nD =
1,4215; tan ít trong nước (4,2 g/100 ml, 16oC) và trộn lẫn hầu hết với các dung môi
hữu cơ.
Dung môi phân cực không thích hợp để pha loãng TBP khi chiết bởi vì nó gây ảnh
hưởng mạnh giữa các phân tử trong dung môi và làm giảm khả năng chiết của TBP.
Những dung môi không phân cực như CCl4, kerosene, iso–octane và benzene thường
được dung pha loãng TBP để điều khiển khả năng chiết và độ nhớt của tướng hữu cơ.
Tỷ số D (CCl4/H2O)=2.10-3,102oC (tại HNO3 1M đến 12M và 0,00732 M TBP).
5. Quá trình chiết với TBP
Việc chiết các ion kim loại với TBP thường thực hiện trong môi trường acid mạnh
với acid HCl hoặc HNO3. Ví dụ, Fe(III) được chiết lần lượt dưới dạng H[FeCl4(TBP)2
và FeCl3(TBP)3 từ HCl 6 và 2 M tương ứng. Do đó, sự thay đổi môi trường acid ảnh
hưởng rất lớn đến khả năng chiết. Việc gia tăng môi trường acid cũng có thể làm giảm
sự thuỷ phân của các ion kim loại đa hoá trị, kết quả là khả năng chiết cao hơn.
Trong việc chiết UO2+ từ dung dịch acid nitric, phản ứng có thể viết như sau:
(
)
(
)
2
3org 23
22org
2UO 2NO 2TBP UO NO TBP
+−
++
(
)
(
)
[]
23
22
org
ex 22
2
2
3org
UO NO TBP
KUO NO TBP
+−
⎡
⎤
⎣
⎦
=⎡⎤⎡⎤
⎣⎦⎣⎦
Hằng số phân ly của U(VI) có thể được viết như sau:
()
()
[]
23 22
22
org
ex 3
2org
2
UO NO TBP
DKNOTBP
UO
−
−
+
⎡⎤
⎣⎦
⎡⎤
==
⎣⎦
⎡⎤
⎣⎦
Khả năng chiết TBP có thể được cải thiện bằng cách dùng nồng độ TBP cao hơn
và nồng độ ion nitrat cao hơn, quá trình chiết được thực hiện ở tướng lỏng. Các muối
nitrate như NaNO3 hoặc Al(NO3)3 thường được dùng để làm tăng khả năng chiết. Các
muối này hoạt động như là các tác nhân gây kết tủa.
Hằng số phân ly của các nguyên tố trong quá trình chiết TBP không pha loãng từ
dung dịch HCl hoặc HNO3 trong môi trường acid khác nhau được tổng hợp trong bảng
XI.1.1. Khi chiết từ dung dịch HNO3, TBP cộng gộp với acid nitric tạo thành (TBP

http://www.ebook.edu.vn
243
HNO3), kết quả là làm giảm khả năng chiết vì nồng độ TBP giảm. Việc tiếp xúc lâu dài
của TBP với các dung dịch acid làm cho một phần TBP bị thuỷ phân, đó là nguyên
nhân làm thay đổi tính chất chiết của TBP. Trong dung dịch HNO3 70%, khả năng
cộng gộp của TBP bị chậm lại ở nhiệt độ phòng.
TBP cũng dùng làm tương trợ cho sự chiết phức kim loại vòng càng bão hoà phối
trí không mang điện tích, ví dụ bằng phản ứng dưới đây:
(
)
(
)
3
org 32org
Ln 3HL 2TBP Ln L TBP 3H
+ +
++ +
Ln3+ và HL đại diện cho ion lantanic và β–diketone tương ứng. Giá trị của Kex đối
với một vài β–diketone được tổng hợp trong bảng XI.1.2.
TBP cũng được dùng làm pha tĩnh trong phương pháp sắc ký pha đảo xác định các
ion kim loại.
6. Tinh chế thuốc thử
Các chất gây nhiễm chính trong sản phẩm là các chất hữu cơ pyrophosphates,
mono– và dibutylphosphates và butanol, có thể xử lý bằng cách cho phản ứng với HCl
8N sau đó phản ứng với dung dịch NaOH 0,4% nóng hoặc Na2CO3 5%, cuối cùng lặp
lại với nước nhiều lần. Mẫu ẩm được làm khô ở 30oC dưới chân không.
Bảng XI.1.2: SỰ TRỢ CHIẾT OF CÁC NGUYÊN TỐ ĐẤT HIẾM
VỚI β–DIKETONE VÀ TBP TRONG CYCLOHEXANE
Thuốc thử chiếta
HFA–TBP TAA–TBP FHD–TBP
Ion kim
loại
log β2 log Kex log β2 log Kex log β2 log Kex
Eu 10,84 5,05 – -2,22 10,00 10,06
Nd 10,50 4,35 – -2,77 9,96 9,95
Tm 10,76 4,63 – -2,62 10,20 10,47
a: chủ yếu cho β–diketone;
HFA: Hexafluoroacetylacetone;
TAA: Trifluoroacetylacetone;
FHD: Decafluoroheptanedione
()
[][ ]
32org
232
org
ML . TBP
ML TBP
β
⎡⎤
⎣⎦
=
()
[][ ]
3
22org
ex 32
3
org
ML . TBP H
KMHLTBP
+
+
⎡⎤
⎡⎤
⎣⎦
⎣⎦
=⎡⎤
⎣⎦
X.2. TRI–n–OCTYLPHOSPHINE OXIDE
CTCT
CTPT: C14H51OP
nC
8H7
nC
8H7
nC
8H7PO

http://www.ebook.edu.vn
244
KLPT: 386,65
1. Danh pháp
TOPO
2. Nguồn gốc và phương pháp tổng hợp
Thuốc thử này có giá trị về mặt kinh tế. Nó được điều chế từ sự oxy hóa trioctyl
phosphine với acid nitric (HNO3) hoặc từ phản ứng Grignard của octyl bromide với
POCL3
3. Ứng dụng trong phân tích
TOPO được dùng phổ biến như là một phối tử không mang điện cho quá trình chiết
các dạng phức kim loại không bão hoà phối trí.
4. Tính chất của thuốc thử
Thuốc thử này ở dạng tinh thể không màu, nhiệt độ nóng chảy 59,5 – 60oC. Nó bền
trong không khí và có thể được cất giữ nhiều tháng ở nhiệt độ trong phòng mà không
bị hư hỏng. TOPO dễ dàng hòa tan trong cyclohexane (35,6 g/100ml, 25oC) và những
dung môi hữu cơ khác. Nó có thể được tinh chế dựa vào quá trình kết tinh lại từ
cyclohexane.
5. Sự phản ứng với các ion kim loại
Các trạng thái oxy hóa của những ion kim loại hóa trị III, IV, V và VI có thể được
chiết từ hydrochloric (HCl) hoặc acid nitric (HNO3)với dung dịch TOPO trong dung
môi trơ như là Hexane (C6H14), Cyclohexane hoặc Toluene (C6H8). Phần dung dịch
chiết ra được xem như là quá trình solvat hóa chloride (Cl-) hoặc nitrate (NO3-), và
phạm vi chiết thì phụ thuộc nhiều vào môi truờng trung tính hay acid. Hệ số chiết của
nhiều kim loại trong quá trình chiết bằng thuốc thử TOPO từ HCl và HNO3 thì được
tóm tắt trong bảng XI.2.1.
Khi nồng độ acid cao hơn, thì TOPO trong dung môi hữu cơ cũng chiết acid từ
TOPO. HA hoặc TOPO.2HA, do đó hệ số chiết của kim loại giảm dựa vào nồng độ
acid. Khi nồng độ các acid là 2M thì khả năng chiết của các acid sẽ giảm dần từ HNO3
> HClO4 > HCl. Tuy nhiên, việc thêm vào những muối kim loại (ví dụ, KNO3 trong
quá trình chiết từ HNO3) để nâng cao hiệu quả chiết kim loại bằng những phản ứng
muối–kim loại, như được ví dụ ở hình 1.
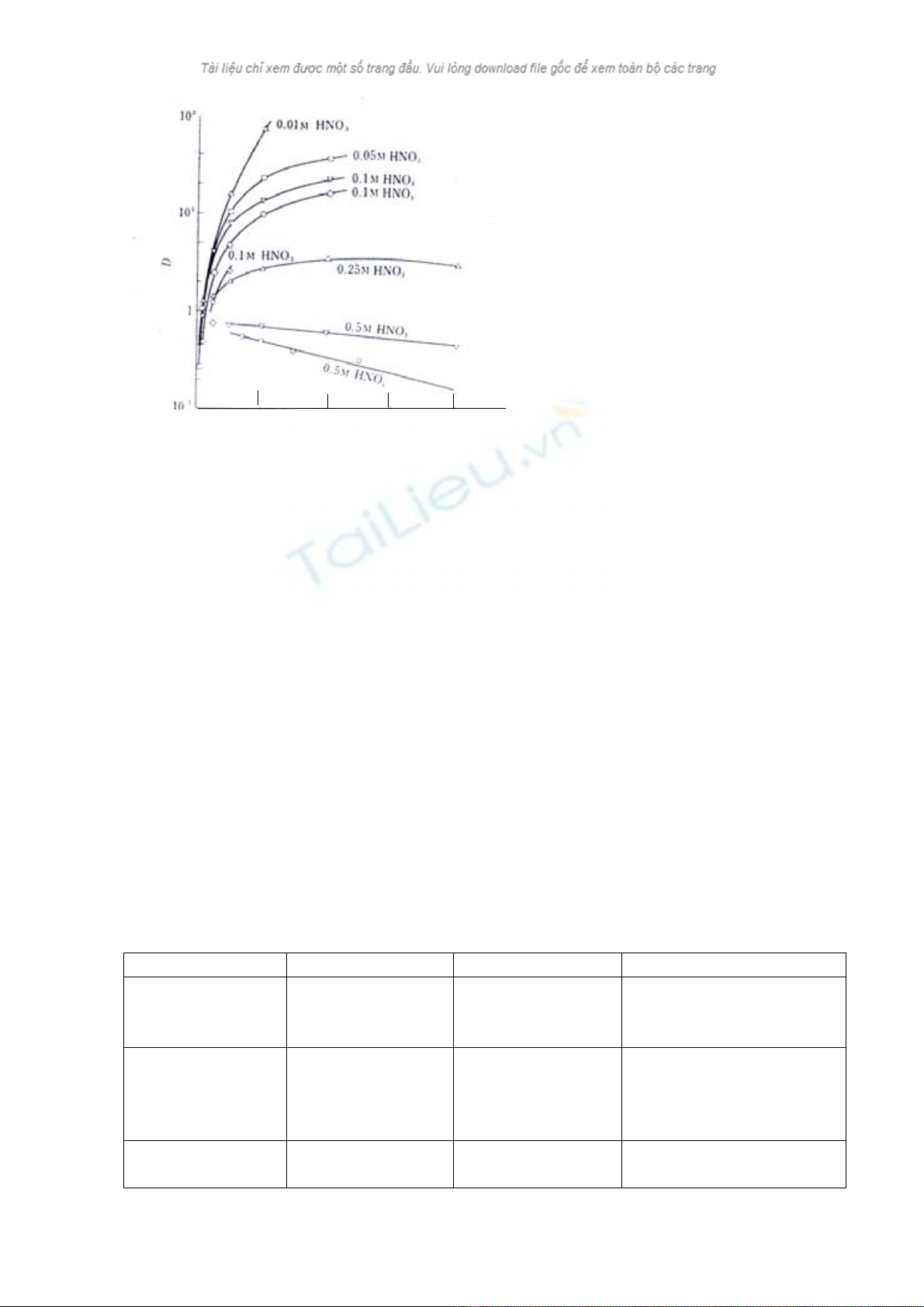
http://www.ebook.edu.vn
245
Thuốc thử TOPO cũng được dùng như một loại phối tử phụ không tích điện để cải
thiện quá trình chiết thì được gọi là “phức kim loại không mang điện chưa bão hoà
phối trí”. Như vậy hiệu quả (synergistic) của TOPO có thể được tìm thấy thường
xuyên trong việc chiết các ion kim loại đa hóa trị, các nguyên tố đất hiếm, các ion
quang hóa. Có một vài ví dụ được trình bày trong bảng XI.2.2
5. Những thuốc thử khác có quan hệ về cấu trúc với TOPO
Tri–n–butylphosphine oxide , TBPO:
Công thức phân tử: (n–C4H9)3Po hay C12H27OP
Khối lượng phân tử: 218,33
Nó là chất rắn ngậm nước không màu, nóng chảy 62 tới 64oC; điểm sôi từ 127 tới
133oC tương ứng với (1 torr), và độ hòa tan trong nước khoảng (5,6g/100ml, 25oC,
nhưng độ hoà tan này tăng hay giảm tùy thuộc vào nhiệt độ) và trong cùng dung môi
hữu cơ. Độ hoà tan của nước trong TBPO là 37,5g/100 ml ở 25oC. Còn độ hoà tan của
toluene trong nước là 3,8 khi HCl 0,5N và bằng 3,0 khi HCl 1,04N, bằng 1,92 khi HCl
2,07N. Nói chung, TBPO cũng có những tính chất giống như TOPO và dùng trong
việc chiết kim loại. Việc chiết nhiều ion kim loại từ HCl với dung dịch TBPO 1%
trong toluene thì đã được nghiên cứu.
Bảng XI.2.2: MỘT VÀI VÍ DỤ CHIẾT TRỢ PHỨC VỚI TOPO
Ion kim loại Điều kiện Dung môi chiết Chú ý
Actinides HNO3 0,1-0,5M,
BMPB 0,05M
Benzene hoặc
cyclohexan
chiết Am, Bk,Cf,
Cm[Ac(PMBP)3.(TOPO)
]
Co(II) pH 5-9, BPA hoặc
β-diketone
Hexane hoặc
cyclohexane
Chiết như là Co(β-
diketone)2.TOPO;Cu, Fe,
Mn, Ni, citrate, EDTA
ảnh hưởng
Cu(II) LIX 54®(RH),
NO3-
Toluene chiết như là
CuR2(TOPO)
1
Hình1: Chiết kim loại với TOPO từ
dung dịch HNO3 ở nồng độ NO3- khác
nhau.
2 3 4

![Tài liệu học tập Thực hành hóa học hữu cơ Phần 2: [Mô tả chi tiết hơn về nội dung thực hành nếu có thể]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20240408/khanhchi090625/135x160/153592762.jpg)
![Tài liệu học tập Thực hành hóa học hữu cơ Phần 1: [Thêm từ khóa giá trị cao liên quan nếu có]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20240408/khanhchi090625/135x160/629001320.jpg)


![Giáo trình Hoá học hữu cơ Trần Thanh Thảo: [Mô tả/Đánh giá/Tóm tắt nội dung giáo trình]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20240329/mucnang555/135x160/5831711710643.jpg)




![Giáo trình thực hành hóa hữu cơ CĐ Công nghiệp 4: [Hướng dẫn/ Tài liệu]](https://cdn.tailieu.vn/images/document/thumbnail/2014/20140312/kimkhanhkh/135x160/9921394618718.jpg)















