
TÀI LI U SÁNG T O ĐT GI I NGÀNH GIÁO D CỆ Ạ Ạ Ả Ụ
H TH NG HOÁ Ệ Ố
TOÀN B KI N TH C L P 8-9Ộ Ế Ứ Ớ
Ng i so n: ườ ạ Nguy n Th Lâm ễ ế
Coppy by: kiemmals
Giáo viên tr ng THCS Phú Lâmườ
Đn v : ơ ị Huy n Tiên Duệ
Mã s tài li u: TLGD-BN003-TD002305ố ệ
Ch c năng c b nứ ơ ả :
-H th ng hóa ki n th c, giúp h c sinh nh nhanh, nh sâu.ệ ố ế ứ ọ ớ ớ
-So sánh, t ng h p, khái quát hoá các khái ni m.ổ ợ ệ
-Đa ra d i d ng các công th c, s đ d hi u, kích thích tính ư ướ ạ ứ ơ ồ ễ ể
tò mò, t tìm hi u c a h c sinh.ự ể ủ ọ
Ngoài ra có th chia axit thành axit m nh và axit y uể ạ ế
Axit m nhạAxit trung bình Axit y uếAxit r t y uấ ế
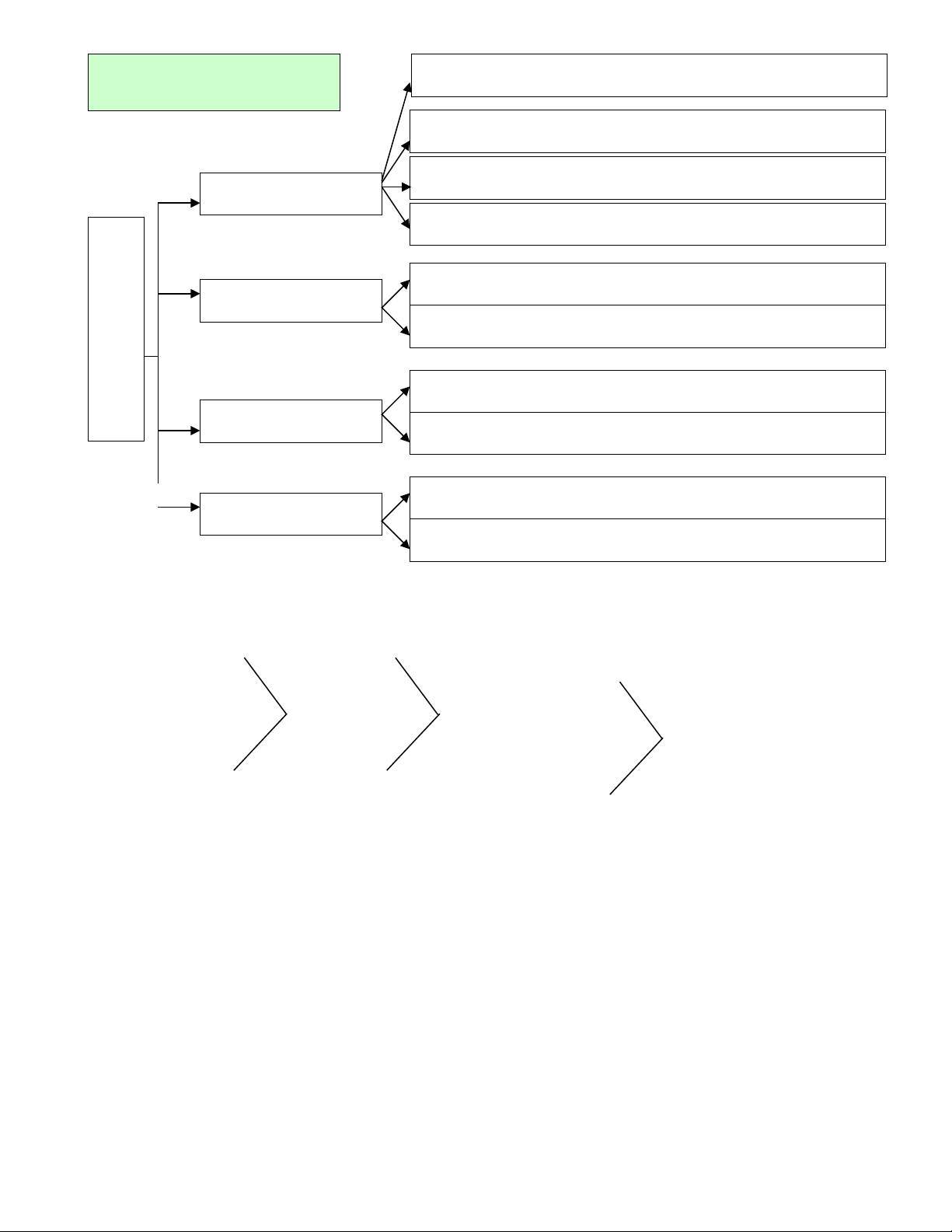
H P CH T VÔ CỢ Ấ Ơ
Oxit (AxOy)
Axit (HnB)
BAZ - M(OH)Ơn
MU I (MỐxBy)
Oxit axit: CO2, SO2, SO3, NO2, N2O5, SiO2, P2O5
Oxit baz : Liơ2O, Na2O, K2O, CaO, BaO,
Oxit trung tính: CO, NO…
Oxit l ng tính: ZnO, Alưỡ 2O3, Cr2O3
Axit không có oxi (Hidraxit): HCl, HBr, H2S, HF
Axit có oxi (Oxaxit): HNO3, H2SO4, H3PO4 ….
Baz tan (Ki m): NaOH, KOH, Ca(OH)ơ ề
2,
Baz không tan: Mg(OH)ơ2, Cu(OH)2, Fe(OH)3 …
Mu i axit: NaHSOố4, NaHCO3, Ca(HCO3)2 …
Mu i trung hoà: NaCl, KNOố3, CaCO3 …
PHÂN LO I Ạ
HNO3
H2SO4
HCl
H3PO4
H2SO3CH3COOH H2CO3
H2S
OXIT AXIT BAZƠMU IỐ
ĐNHỊ
NGHĨA
Là h p ch t c a oxi v i 1 nguyên tợ ấ ủ ớ ố
khác
Là h p ch t mà phân t g m 1 hayợ ấ ử ồ
nhi u nguyên t H liên k t v i g cề ử ế ớ ố
axit
Là h p ch t mà phân t g m 1ợ ấ ử ồ
nguyên t kim lo i liên k t v i 1ử ạ ế ớ
hay nhi u nhóm OHề
Là h p ch t mà phân t g m kim ợ ấ ử ồ
lo i liên k t v i g c axit.ạ ế ớ ố
CTHH
G i nguyên t trong oxit là A hoá tr n.ọ ố ị
CTHH là:
- A2On n u n lế ẻ
- AOn/2 n u n ch nế ẵ
G i g c axit là B có hoá tr n. ọ ố ị
CTHH là: HnB
G i kim lo i là M có hoá tr nọ ạ ị
CTHH là: M(OH)n
G i kim lo i là M, g c axit là Bọ ạ ố
CTHH là: MxBy
TÊN G IỌ
Tên oxit = Tên nguyên t + oxitố
L u ý: Kèm theo hoá tr c a kim lo i ư ị ủ ạ
khi kim lo i có nhi u hoá tr .ạ ề ị
Khi phi kim có nhi u hoá tr thì kèm ề ị
ti p đu ng .ế ầ ữ
- Axit không có oxi: Axit + tên phi kim
+ hidric
- Axit có ít oxi: Axit + tên phi kim + ơ
(r )ơ
- Axit có nhi u oxi: Axit + tên phi kimề
+ ic (ric)
Tên baz = Tên kim lo i + hidroxitơ ạ
L u ý: Kèm theo hoá tr c a kimư ị ủ
lo i khi kim lo i có nhi u hoá tr .ạ ạ ề ị
Tên mu i = tên kim lo i + tên g c ố ạ ố
axit
L u ý: Kèm theo hoá tr c a kim ư ị ủ
lo i khi kim lo i có nhi u hoá tr .ạ ạ ề ị
TCHH
1. Tác d ng v i n cụ ớ ướ
- Oxit axit tác d ng v i n c t oụ ớ ướ ạ
thành dd Axit
- Oxit baz tác d ng v i n c t oơ ụ ớ ướ ạ
thành dd Bazơ
2. Oxax + dd Baz t o thành mu i vàơ ạ ố
n cướ
3. Oxbz + dd Axit t o thành mu i vàạ ố
n cướ
4. Oxax + Oxbz t o thành mu iạ ố
1. Làm qu tím ỳ đ h ngỏ ồ
2. Tác d ng v i Baz ụ ớ ơ Mu i vàố
n cướ
3. Tác d ng v i oxit baz ụ ớ ơ mu i vàố
n cướ
4. Tác d ng v i kim lo i ụ ớ ạ mu i vàố
Hidro
5. Tác d ng v i mu i ụ ớ ố mu i m i vàố ớ
axit m iớ
1. Tác d ng v i axit ụ ớ mu i vàố
n cướ
2. dd Ki m làm đi màu ch t ch thề ổ ấ ỉ ị
- Làm qu tím ỳ xanh
- Làm dd phenolphtalein không màu
h ngồ
3. dd Ki m tác d ng v i oxax ề ụ ớ
mu i và n cố ướ
4. dd Ki m + dd mu i ề ố Mu i +ố
Bazơ
5. Baz không tan b nhi t phân ơ ị ệ
oxit + n cướ
1. Tác d ng v i axit ụ ớ mu i m i +ố ớ
axit m iớ
2. dd mu i + dd Ki m ố ề mu i m iố ớ
+ baz m iơ ớ
3. dd mu i + Kim lo i ố ạ Mu i m iố ớ
+ kim lo i m iạ ớ
4. dd mu i + dd mu i ố ố 2 mu i m iố ớ
5. M t s mu i b nhi t phânộ ố ố ị ệ
L u ýư- Oxit l ng tính có th tác d ng v iưỡ ể ụ ớ
c dd axit và dd ki mả ề - HNO3, H2SO4 đc có các tính ch tặ ấ
riêng
- Baz l ng tính có th tác d ngơ ưỡ ể ụ
v i c dd axit và dd ki mớ ả ề - Mu i axit có th ph n ng nh 1ố ể ả ứ ư
axit
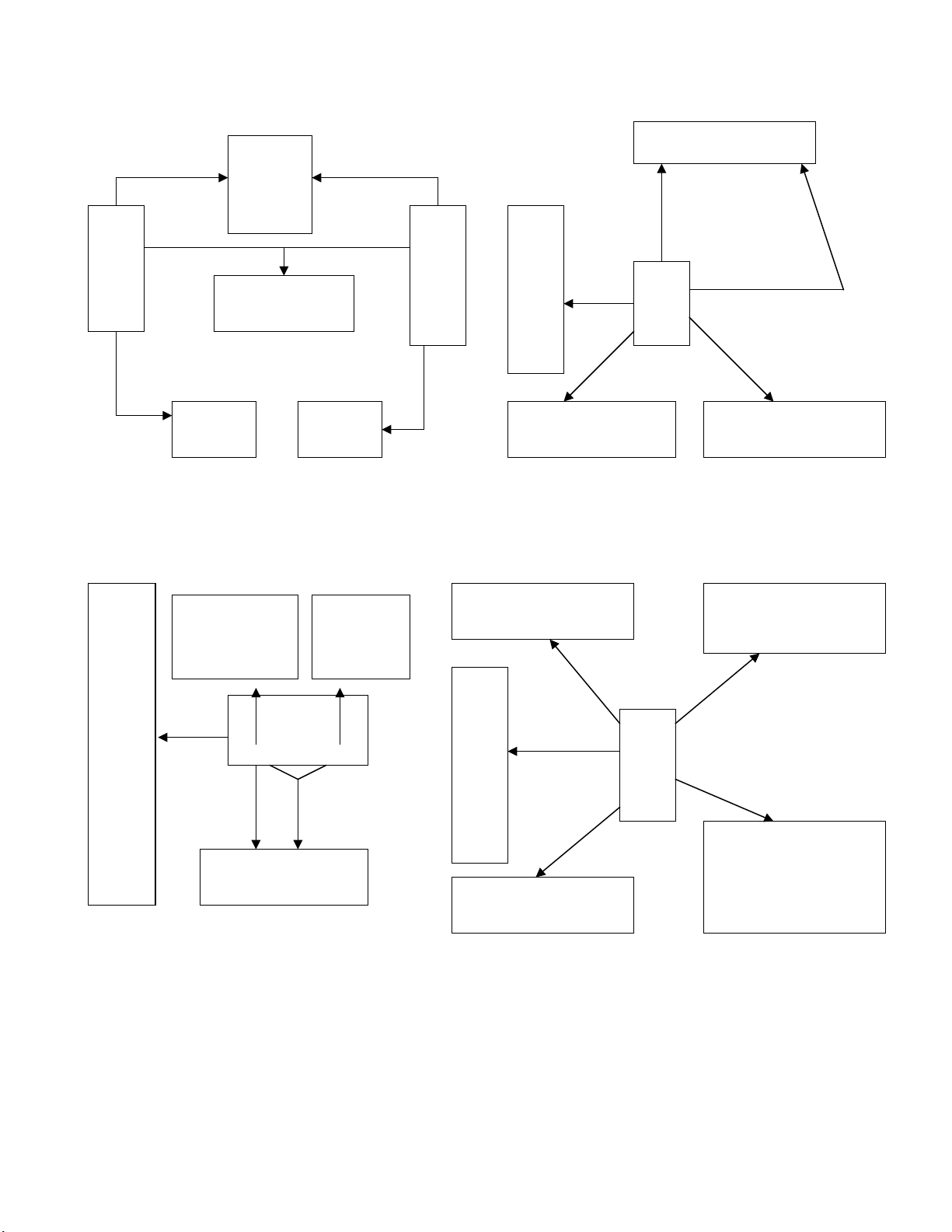
TÍNH CH T HOÁ H C C A CÁC H P CH T VÔ CẤ Ọ Ủ Ợ Ấ Ơ
+ dd Mu iố
+ axit
+ dd bazơ+ kim lo iạ
t0
+ dd mu iố
t0
+ axit+ Oxax
+ Oxit Bazơ
+ Bazơ
+ dd Mu iố
+ KL+ N cướ+ N cướ
Oxit axit
OXIT BAZƠ
MU IỐ
+
NƯỚ
C
axit KI MỀ
MU IỐ
+ dd Axit+ dd Bazơ
Axit
MU I + H2OỐ
QU TÍM Ỳ ĐỎ
MU I + HỐ2MU I + AXITỐ
MU IỐ
BAZƠ
KI M K.TANỀ
QU TÍM Ỳ XANH
PHENOLPHALEIN K.MÀU H NGỒ
MU I + HỐ2O
oxit +
h2O
MU I + AXITỐ
MU I + BAZỐ Ơ
MU I + MU IỐ Ố
MU I + KIMỐ
LO I Ạ
CÁC
S N PH MẢ Ẩ
KHÁC NHAU
TCHH C A OXITỦTCHH C A AXITỦ
TCHH C A MU IỦ ỐTCHH C A BAZỦ Ơ
L u ý:ưTh ng ch g p 5 oxit baz tan đc trong n c là Liườ ỉ ặ ơ ượ ướ 2O, Na2O, K2O, CaO,
BaO. Đây cũng là các oxit baz có th tác d ng v i oxit axit.ơ ể ụ ớ
Đi v i baz , có các tính ch t chung cho c 2 lo i nh ng có nh ng tínhố ớ ơ ấ ả ạ ư ữ
ch t ch c a Ki m ho c baz không tanấ ỉ ủ ề ặ ơ
M t s lo i h p ch t có các tính ch t hoá h c riêng, trong này không độ ố ạ ợ ấ ấ ọ ề
c p t i, có th xem ph n đc thêm ho c các bài gi i thi u riêng trong sgk.ậ ớ ể ầ ọ ặ ớ ệ
MU I +Ố
BAZƠ







![Hệ thống kiến thức Hóa học hữu cơ Lớp 9 [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20160726/nxuanchinh27/135x160/1874025_7793.jpg)



















