
Ph n 1 ầ
QUANG H CỌ
Ch ng I PH H P TH PHÂN T UV - VISươ Ổ Ấ Ụ Ử
I. C s lí thuy tơ ở ế
I.1.Vài nét l ch s c a ph ng pháp UV-VISị ử ủ ươ
Trong chi n tranh th gi i th II, n c M mu n quân lính c a h ph iế ế ớ ứ ướ ỹ ố ủ ọ ả
đc chăm sóc t t nh ng các nhà khoa h c v n ch a có ý t ng nào v lo iượ ố ư ọ ẫ ư ưở ề ạ
vitamin gì trong th c ăn. Chính ph c n m t ph ng pháp r nh ng xác đnh đcứ ủ ầ ộ ươ ẻ ư ị ượ
nhanh và hi u qu l o vitamin ch a trong th c ăn. Công ngh m i c a ph UVệ ả ạ ứ ứ ệ ớ ủ ổ
đc đ ngh nh ng các công c r t đt và ph i đc th c hi n b ng tay.ượ ề ị ư ụ ấ ắ ả ượ ự ệ ằ
Năm 1941, máy quang ph kh ki n và t ngo i Beckman DU đã đc gi iổ ả ế ử ạ ượ ớ
thi u và xác đnh s có m t c a các vitamin trong th c ăn m t cách nhanh chóng vàệ ị ự ặ ủ ứ ộ
d dàng b ng cách hi n lên trên máy DU. ễ ằ ệ
Ph t h p th phân t UV-VIS là d ng ph lâu đi nh t. Nó liên quan đnổ ử ấ ụ ử ạ ổ ờ ấ ế
ph c a photon, s d ng ánh sáng trong vùng nhìn th y và vùng t ngo i và g nổ ủ ử ụ ấ ử ạ ầ
h ng ngo i (200 - 800nm).ồ ạ
Bánh xe màu
UV-VIS nghĩa là “ beyond violet” ( xa h n màu tím), violet là màu c a b cơ ủ ướ
sóng ng n nh t c a ánh sáng nhìn th y. M t vài b c sóng UV th ng g i ánh sángắ ấ ủ ấ ộ ướ ườ ọ
đen, khi nó không th nhìn th y đi v i m t ng i. M t vài đng v t bao g m:ể ấ ố ớ ắ ườ ộ ộ ậ ồ
chim, bò sát và côn trùng nh ong có th nhìn th y vùng g n t ngo i. Nhi u tráiư ể ấ ầ ử ạ ề
cây, hoa và h t gi ng có th ch u đng đc trong vùng t ngo i. Nhi u loài chimạ ố ể ị ự ượ ử ạ ề
có nhi u ph n trên b lông c a chúng không th nhìn th y b c sóng th ngề ầ ộ ủ ể ấ ở ướ ườ
nh ng có th th y đc trong vùng t ngo i ư ể ấ ượ ử ạ
1

I.2. S h p th quang UV-VISự ấ ụ
Các phân t , nhóm phân t c a các ch t, đn ch t hay h p ch t cũng đuử ử ủ ấ ơ ấ ợ ấ ề
đc c u t o t nh ng nguyên t theo nh ng cách, ki u liên k t hoá h c nh t đnhượ ấ ạ ừ ữ ử ữ ể ế ọ ấ ị
c a các đi n t hoá tr ( các electron l p ngoài cùng ) c a các nguyên t . Tuy cóủ ệ ử ị ớ ủ ố
muôn vàn các ch t khác nhau đc t o thành t các nguyên t nh ng trong phân tấ ượ ạ ừ ử ư ử
các ch t ch có 3 lo i liên k t hoá h c. Đó là liên k t xicma ( ), liên k t pi ( ) vàσ πấ ỉ ạ ế ọ ế ế
liên k t ph i trí ( cho nh n ). Ngoài ra n u phân t các ch t ch a nguyên t d t ,ế ố ậ ế ử ấ ứ ố ị ố
nh nit (N), oxi (O), l u hu nh (S) thì nguyên t này có th còn đôi đi n t hoáư ơ ư ỳ ở ố ể ệ ử
tr ch a tham gia liên k t, kí hi u là n. Ví d trong phân t NHị ư ế ệ ụ ử 3 nguyên t N có 5ử
electron hoá tr , m i đem 3 electron liên k t v i 3 nguyên t hiđro t o ra 3 liên k t ,σị ớ ế ớ ử ạ ế
do đó nó còn m t đôi đi n t t do.ộ ệ ử ự
Trong phân t , hay nhóm nguyên t , các liên k t có năng l ng nh nh t,σử ử ế ượ ỏ ấ
sau đó l n h n là đn liên k t pi và cao h n c là đôi đi n t t do n. Các phân t ,ớ ơ ế ế ơ ả ệ ử ự ử
nhóm nguyên t c a các ch t đi u ki n bình th ng chúng t n t i tr ng thái cử ủ ấ ở ề ệ ườ ồ ạ ở ạ ơ
b n, tr ng thái này b n v ng và nghèo năng l ng. Nh ng khi có chùm sáng (chùmả ạ ề ữ ượ ư
photon) có năng l ng thích h p chi u vào nó, kích thích nó thì các đi n t hoá trượ ợ ế ệ ử ị
trong liên k t xicma, pi và đôi đi n t t do n trong phân t s h p th năng l ngế ệ ử ự ử ẽ ấ ụ ượ
c a chùm sáng và chuy n lên tr ng thái kích thích có năng l ng cao h n. Theo củ ể ạ ượ ơ ơ
h c l ng t , tr ng thái c b n c a phân t , các đi n t đc s p đy vào cácọ ượ ử ở ạ ơ ả ủ ử ệ ử ượ ắ ầ
obitan liên k t , , n (c p electron t do) có m c năng l ng th p trong phân t .σ πế ặ ự ứ ượ ấ ử
Các đi n t hoá tr c a liên k t này n m trong các phân l p p, d, f trong các liênπệ ử ị ủ ế ằ ớ
k t lo i p-p, d-d, f-f, d-p, d-f ...Các electron hoá tr khi đi vào liên k t trong phân tế ạ ị ế ử
hình thành các lo i liên k t lo i và . Đng th i trong m t s nguyên t v n cònσ πạ ế ạ ồ ờ ộ ố ử ẫ
các đôi đi n t t do n. Khi b kích thích chúng s có s chuy n lên các m c năngệ ử ự ị ẽ ự ể ứ
l ng cao nh sau:ượ ư
σ → σ* ; π → π*
n → σ* ; n → π*
2
t n sầ ố
Năng l ngượ
b c ướ
sóng
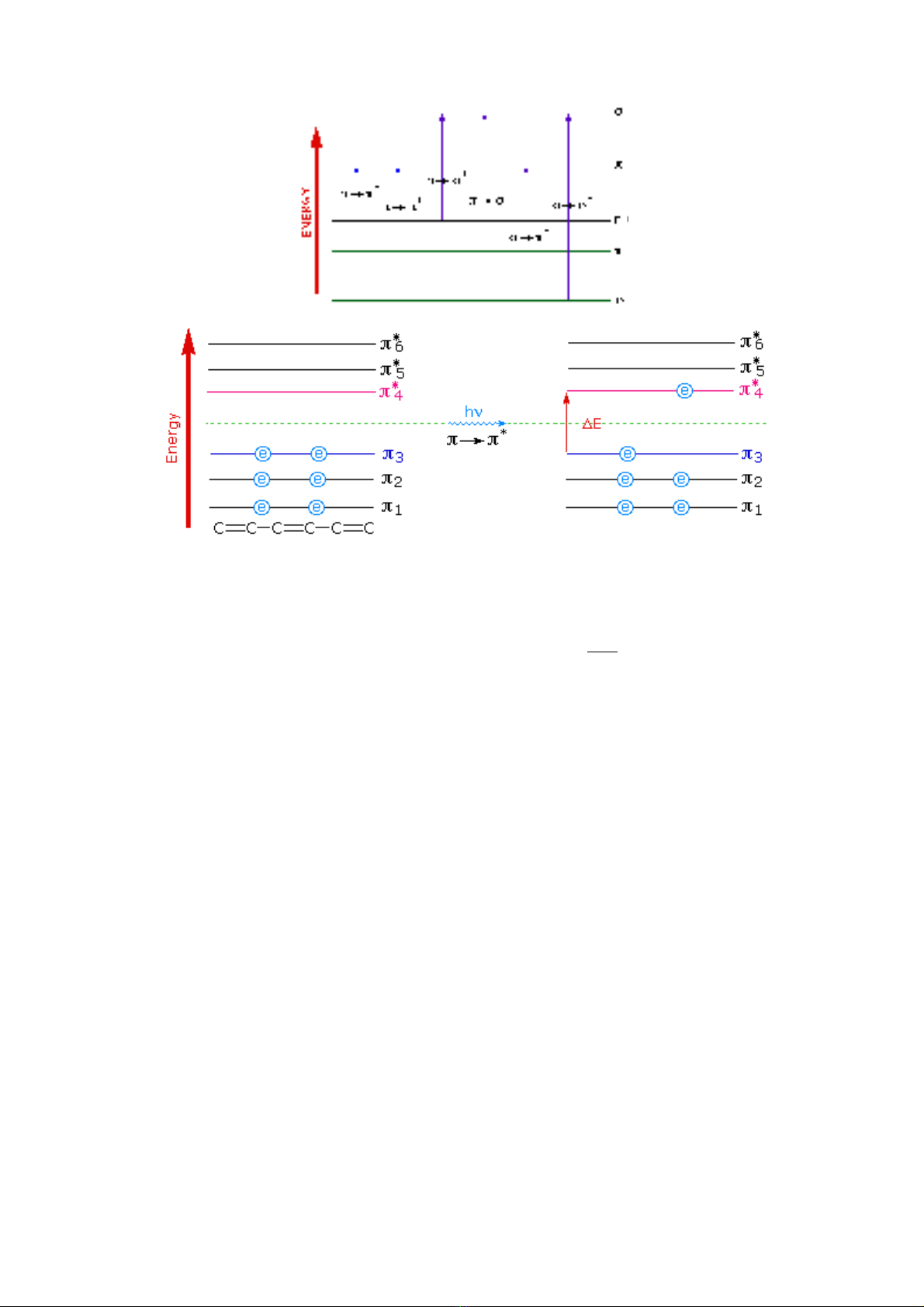
Lúc này phân t đã b kích thích. Hi u s gi a hai m c năng l ng c b n vàử ị ệ ố ữ ứ ượ ơ ả
kích thích chính là năng l ng mà phân t đã h p th đc t ngu n sáng kích thíchượ ử ấ ụ ượ ừ ồ
tác d ng vào chúng theo bi u th c :ụ ể ứ
e n o
h.c
ΔE = E - E = .h = νλ
Song trong quá trình kích thích đó, cùng v i s chuy n m c năng l ng c aớ ự ể ứ ượ ủ
electron liên k t trong phân t (electron trong liên k t xicma và pi), còn kèm theo cế ử ế ả
s quay và dao đng c a nguyên t trong phân t và c phân t , d i tác d ng c aự ộ ủ ử ử ả ử ướ ụ ủ
ngu n sáng kích thích (năng l ng c a chùm photon). Vì th t ng năng l ng màồ ượ ủ ế ổ ượ
mà phân t nh n đc khi b kích thích là bao g m 3 thành ph n:ử ậ ượ ị ồ ầ
ts e d q
E = ΔE + ΔE + ΔE
T ng năng l ng này là t ng ng v i năng l ng c a các chùm sáng n mổ ượ ươ ứ ớ ượ ủ ằ
trong vùng ph UV-VIS. Vì th ph h p th này đc g i là ph h p th phân tổ ế ổ ấ ụ ượ ọ ổ ấ ụ ử
UV-VIS. Trong 3 thành ph n này thì ΔEầe > ΔEd > ΔEq và ch có thành ph n ΔEỉ ầ e đcượ
l ng t hoá, theo các m c năng l ng, các obitan c a phân t MO. Vì th ph h pượ ử ứ ượ ủ ử ế ổ ấ
th phân t trong vùng UV-VIS c a các ch t không ph i ph v ch, nh ph phát xụ ử ủ ấ ả ổ ạ ư ổ ạ
hay ph h p th c a các nguyên t . Nghĩa là không có tính đn s c nh trong phổ ấ ụ ủ ử ơ ắ ư ổ
phát x và h p th các nguyên t tr ng thái khí t do, mà đây là ph băng, cóạ ấ ụ ử ở ạ ự ở ổ
đ r ng t 10-100nm, và có các giá tr c c đi và c c ti u t i nh ng sóng nh t đnh.ộ ộ ừ ị ự ạ ự ể ạ ữ ấ ị
Nh v y, ph h p th phân t UV-VIS là ph do có s t ng tác c a cácư ậ ổ ấ ụ ử ổ ự ươ ủ
đi n t hoá tr trong phân t hay nhóm phân t v i chùm tia sáng kích thích ( chùmệ ử ị ở ử ử ớ
tia b c x trong vùng UV-VIS ) t o ra. Nó là ph c a t h p s chuy n m c c aứ ạ ạ ổ ủ ổ ợ ự ể ứ ủ
3
các đi n t liên k t, s quay và dao đng c a phân t . Vì th nó là ph đám, có cácệ ử ế ự ộ ủ ử ế ổ
c c đi và c c ti u c a ph th ng là n m vùng sóng nh t đnh tu theo c u trúcự ạ ự ể ủ ổ ườ ằ ở ấ ị ỳ ấ
và lo i liên k t c a phân t hay nhóm nguyên t có trong h p ch t. Ph này chạ ế ủ ử ử ợ ấ ổ ủ
y u n m trong vùng sóng t 190-900nm. Do đó đc g i là ph h p th UV-VISế ằ ừ ượ ọ ổ ấ ụ
( t ngo i và kh ki n) c a phân t hay nhóm phân t ử ạ ả ế ủ ử ử
4

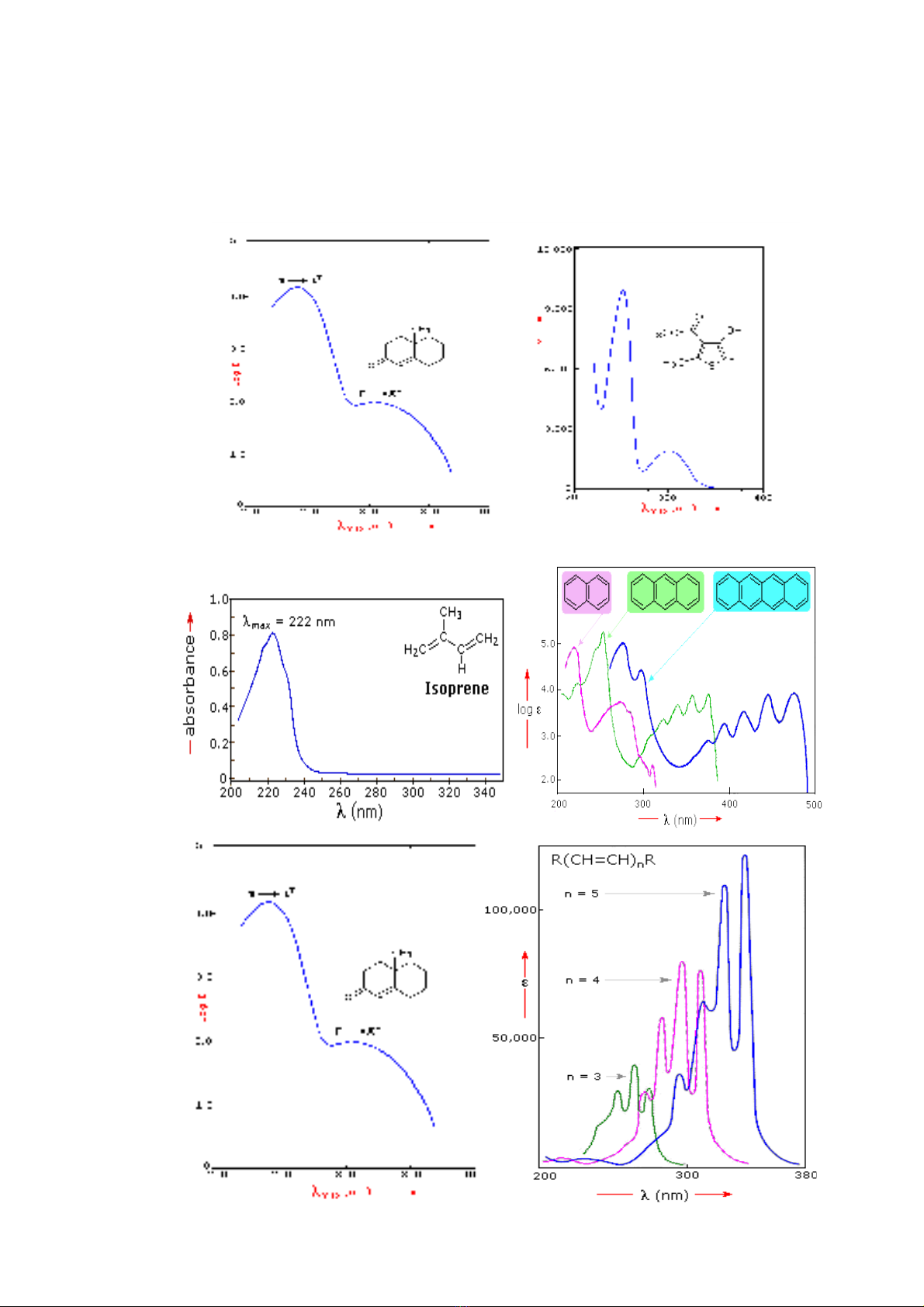
M t s ví d v ph UV-VISộ ố ụ ề ổ
I.3. Nguyên t c c a ph ng phápắ ủ ươ
I.3.1 Đnh lu t Bouguer-Lambertị ậ
Năm 1729, Bouguer đã thi t l p s ph thu c gi a s gi m c ng đ chùmế ậ ự ụ ộ ữ ự ả ườ ộ
sáng đn s c h ng song song và b dày c a l p dung d ch h p th . Năm 1760,ơ ắ ướ ề ủ ớ ị ấ ụ
Lambert đã xác nh n s ph thu c này và thi t l p đnh lu t th nh t c a s h pậ ự ụ ộ ế ậ ị ậ ứ ấ ủ ự ấ
th ánh sáng.ụ
Khi ánh sáng đi qua l p dung d ch th nh t, c ng đ dòng sáng gi m đi nớ ị ứ ấ ườ ộ ả
l n, nên cu i l p th nh t c ng đ ánh sáng b ng: ầ ở ố ớ ứ ấ ườ ộ ằ
0
1
I
I = n
(n>1)
Chùm ánh sáng khi qua l p th hai:ớ ứ
0
1
22
I
I
I = n n
=
Chùm ánh sáng khi qua toàn b b dày l p dung d ch (nghĩa là qua b l p):ộ ề ớ ị ớ
0 0
b
I I
I= lg = b.lgn
n I
Đi l ng ạ ượ
0
I
lg I
g i là đ h p th quang c a dung d ch, kí hi u là A.ọ ộ ấ ụ ủ ị ệ
0
I
A = lg = b.lgn = k.b
I
N i dung đnh lu t Bouguer-Lambert đc phát bi u nh sau:ộ ị ậ ượ ể ư
“ L ng t ng đi c a chùm sáng b h p th b i môi tr ng mà nó đi quaượ ươ ố ủ ị ấ ụ ở ườ
không ph thu c vào c ng đ c a tia t i. M i m t l p b dày nh nhau h p thụ ộ ườ ộ ủ ớ ỗ ộ ớ ề ư ấ ụ
m t ph n dòng ánh sáng đn s c đi qua dung d ch nh nhau”ộ ầ ơ ắ ị ư
1.3.2 Đnh lu t Beerị ậ
Năm 1852, Beer đã thi t l p đnh lu t th hai c a s h p th ánh sángế ậ ị ậ ứ ủ ự ấ ụ
“ S h p th dòng quang năng t l b c nh t v i s phân t c a ch t h pự ấ ụ ỉ ệ ậ ấ ớ ố ử ủ ấ ấ
th mà dòng quang năng đi qua nóụ.”
Hay : “ Đ h p th ánh sáng c a dung d ch màu ( đi l ng m t đ quang A) t lộ ấ ụ ủ ị ạ ượ ậ ộ ỉ ệ
b c nh t v i n ng đ c a dung d ch ch t h p th ánh sángậ ấ ớ ồ ộ ủ ị ấ ấ ụ ”
Bi u th c:ể ứ
0
I
A = lg = K.C
I
K là h s t l , C là n ng đ c a h p ch t màu.ệ ố ỷ ệ ồ ộ ủ ợ ấ
1.3.3 Đnh lu t h p nh t Bouguer-Lambert-Beer ị ậ ợ ấ
Thí nghi m:ệ
5








![Bài giảng Quang học lượng tử [chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2022/20221011/kimphuongq9/135x160/6751665470487.jpg)


![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














