
PHƯƠNG PHAP
PHƯƠNG PHAP
PHÂN TICH KHÔI LƯƠNG
PHÂN TICH KHÔI LƯƠNG

MUC TIÊU HOC TÂP
1. Trinh bay đươc nguyên tăc chung, phân loai cu.a
phương phap phân tich khôi lương.
2. Trinh bay đươc các thao tác cơ bản của phương
phap phân tich khôi lương.
3. Tinh đươc kêt qua. phân tich khối lượng
4. Trình bày được một số ứng dụng của phương
phap phân tich khôi lương.

PHƯƠNG PHÁP PHÂN TÍCH
KHỐI LƯỢNG
1. Nguyên tắc chung:
Dựa vào khối lượng của 1 chất (đã
biết thành phần hóa học) tạo thành tủa
hay bay hơi, tính lượng chất cần xác
định.
VD: MgSO4 + BaCl2 = BaSO4 tủa + MgCl2
=> PP cân
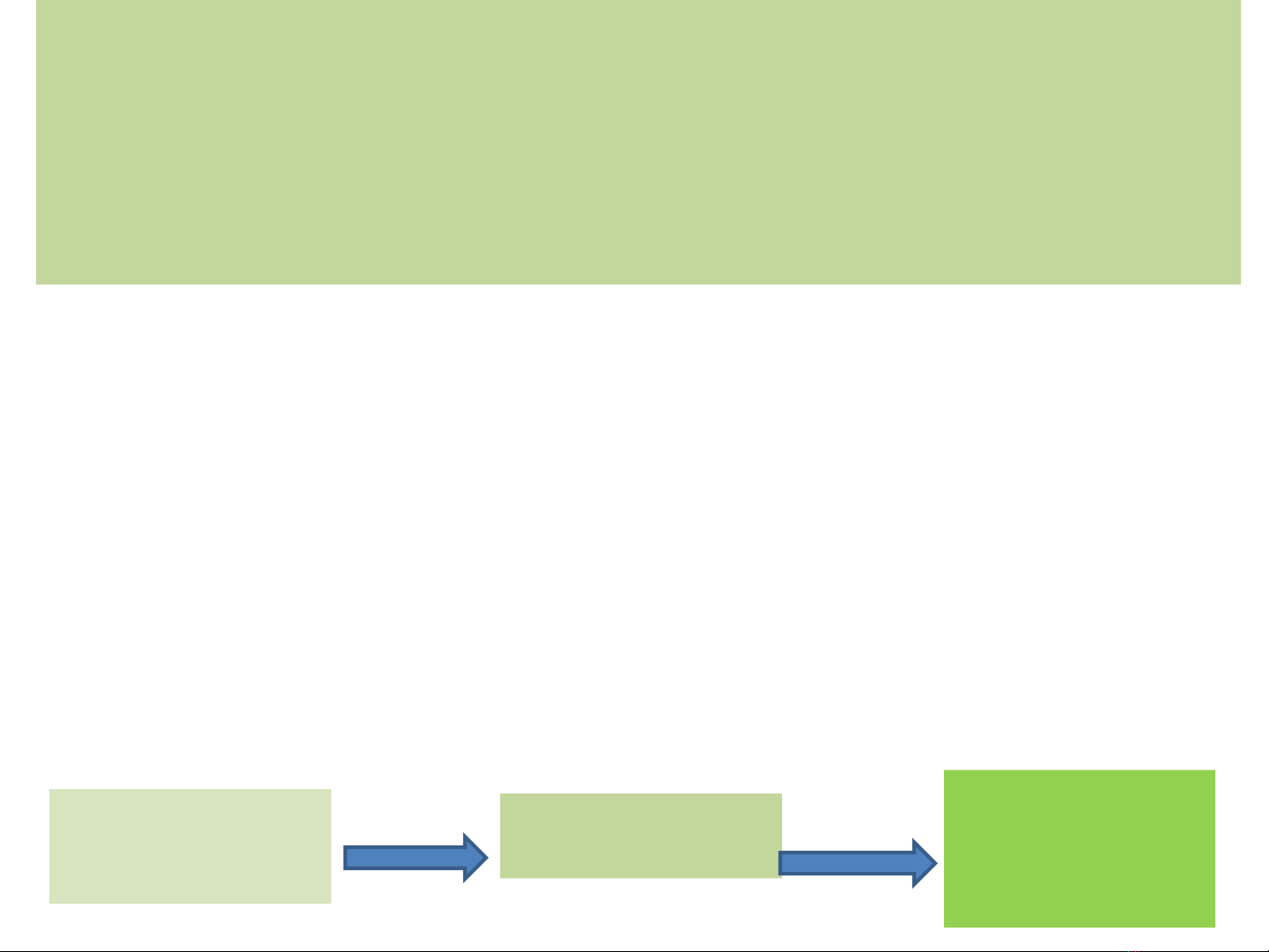
Ví dụ: Định lượng SO42- trong mẫu
SO4 có lẫn tạp chất
+B1: Dùng BaCl2 loãng, dư kết tủa hết SO42-
thành dạng tủa BaSO4
+ B2: Lọc tủa, rửa tủa, nung tủa đến khối
lượng không đổi
+B3: Cân tủa và tính hàm lượng SO42- trong
tủa và trong mẫu
Mẫu
(chứa chất cần xác
định: MgSO4
Dạng tủa
BaSO4
Dạng cân
BaSO4
MgSO4 + BaCl2 = BaSO4 tủa + MgCl2
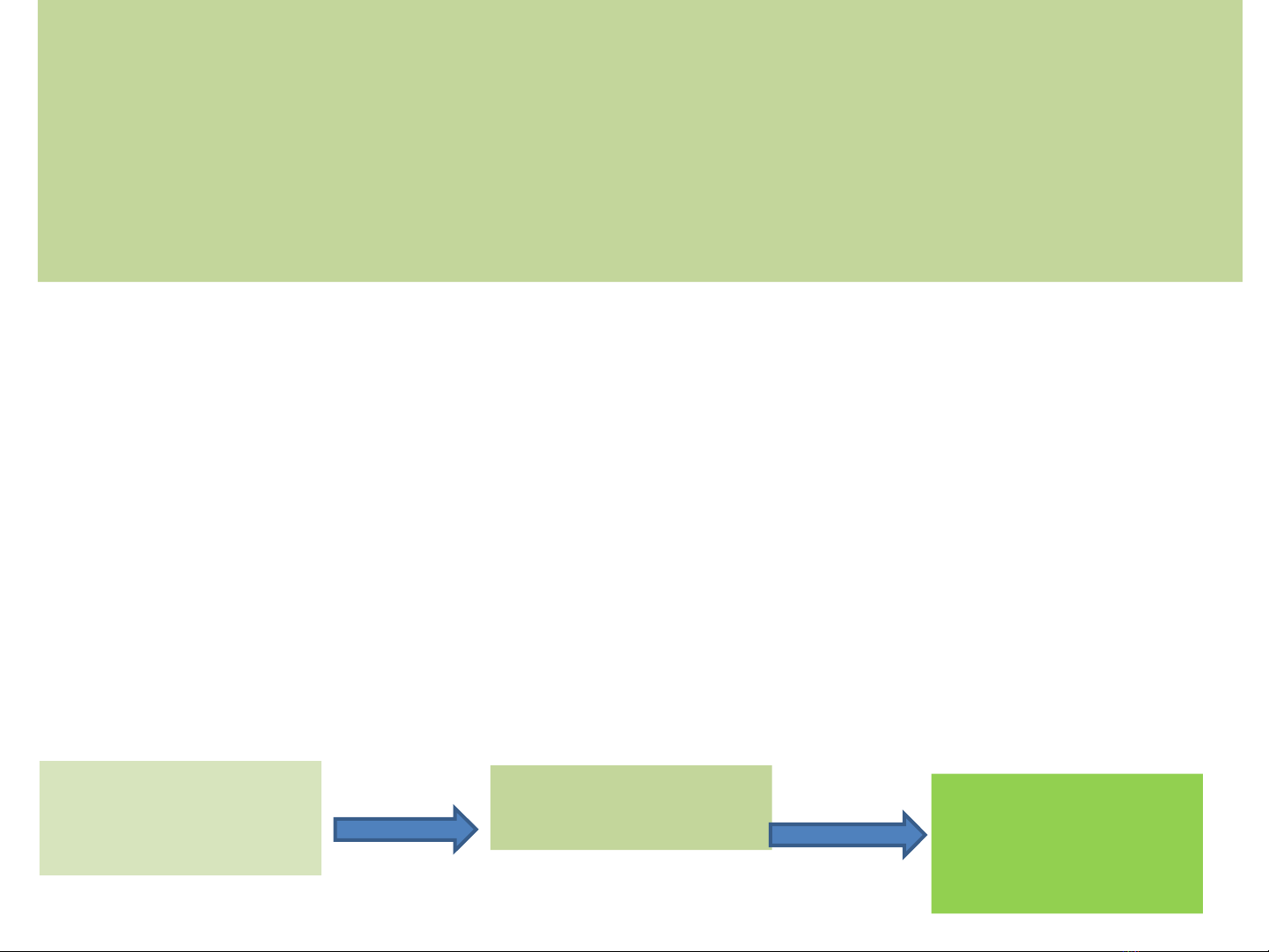
Ví dụ: Định lượng Carbon trong
mẫu K2CO3 có lẫn tạp chất
+B1: Dùng dd HCl loãng, dư phản ứng với K2CO3
thành dạng khí CO2
+ B2: Thu khí CO2, dẫn qua bình nước vôi trong
dư.
+B3: Tính hiệu khối lượng bình nước vôi trước và
sau phản ứng. Tính lượng CO2 và hàm lượng
Carbon trong mẫu
Mẫu
(chứa chất cần xác
định: K2CO3
Dạng khí
CO2
Khối lượng
Bình nước vôi
tăng
K2CO3 + HCl = KCl + CO2 khí + H2O


![Bài tập Hóa lý dược [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250717/0609anhle@gmail.com/135x160/87091752738236.jpg)























