
CHƢƠNG II: LIÊN KẾT HÓA HỌC
I. Các đại lượng đặc trưng cho liên kết hóa học
II. Các loại liên kết theo quan niệm cổ điển.
III. Liên kết cộng hóa trị cặp electron

2
1. Năng lượng liên kết (ELK): Năng lượng tỏa ra khi hình
thành một liên kết giữa hai nguyên tử cô lập
Ví dụ: liên kết H–Cl có ELK = - 432 kJ/mol
Năng lượng cần để phá vỡ liên kết H–Cl là: 432 kJ/mol
2. Độ dài liên kết (r0; ): Khoảng cách giữa hai hạt nhân
của hai nguyên tử tham gia vào liên kết
Ví dụ Liên kết: H-F H-Cl H-Br H-I
d (A0) 0,92 1,28 1,42 1,62
I. Các đại lƣợng đặc trƣng cho liên kết hóa học

3
1. Năng lượng liên kết (ELK): Năng lượng tỏa ra khi hình
thành một liên kết giữa hai nguyên tử cô lập
Ví dụ: liên kết H–Cl có ELK = - 432 kJ/mol
Năng lượng cần để phá vỡ liên kết H–Cl là: 432 kJ/mol
2. Độ dài liên kết (r0; d): Khoảng cách giữa hai hạt nhân
của hai nguyên tử tham gia vào liên kết
Ví dụ Liên kết: H-F H-Cl H-Br H-I
d (A0) 0,92 1,28 1,42 1,62
I. Các đại lƣợng đặc trƣng cho liên kết hóa học
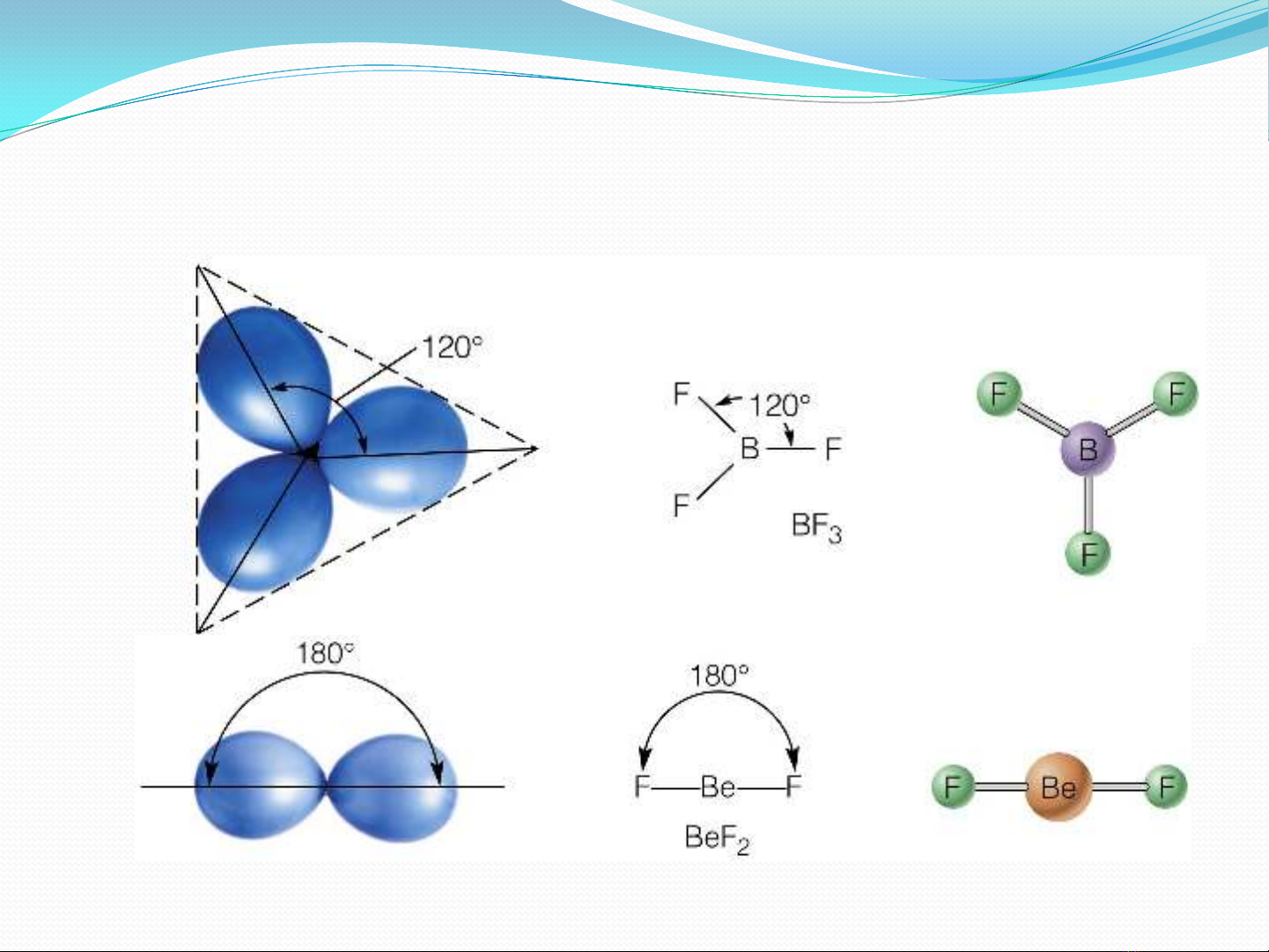
3. Góc liên kết (α ): Góc liên kết hay góc hóa trị là góc
tạo thành bởi 2 đoạn thẳng nối hạt nhân nguyên tử trung
tâm với 2 hạt nhân nguyên tử liên kết.
4

4. Độ bội liên kết: số mối liên kết hình thành giữa hai
nguyên tử
Ví dụ: H – H trong phân tử hidro 2 nguyên tử có 1 mối
liên kết → độ bội liên kết là 1
O = O trong phân tử oxi 2 nguyên tử có 2 mối liên kết
→ độ bội liên kết là 2
N ≡ N trong phân tử Nitơ 2 nguyên tử có 3 mối liên kết
→ độ bội liên kết là 3
Độ bội càng lớn liên kết càng bền
5















![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)










