2
Chương 5: ALKENE
I.
Giớithiệu
chung
•
Alkene: hydrocarbon mạch
hở, chứa
1 liên
kết
đôi
C=C (Cn
H2n
, n≥2)
•
Trong
C=C: 1σ
& 1π, σ
hình
thành
do liên
kếtcủa
orbital sp2
http://hhud.tvu.edu.vn
3
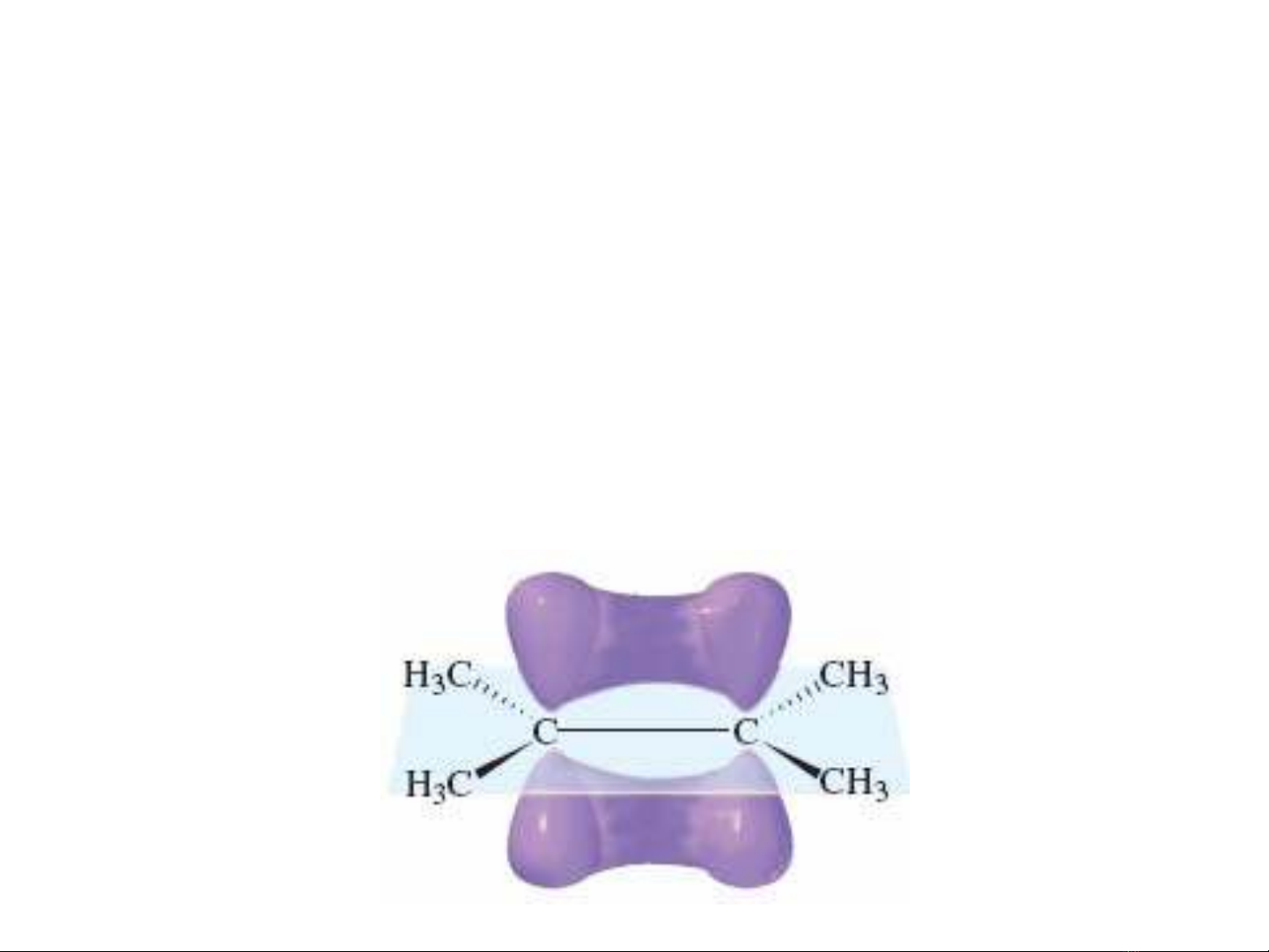
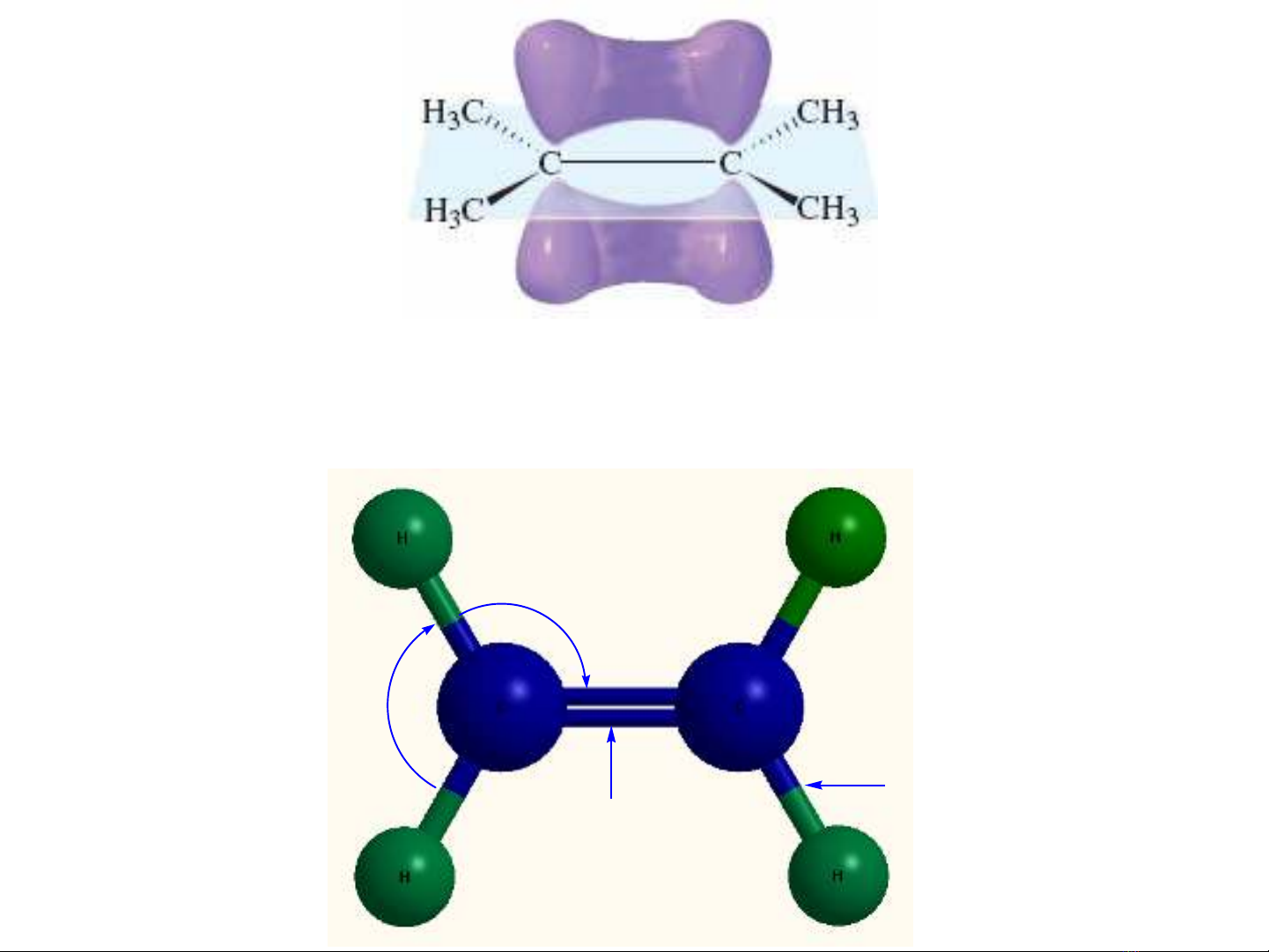
•Liên
kết
π
vuông
góc
vớimặtphẳng
phân
tử
•Alkene
đơngiảnnhất
là
ethylene CH2
=CH2
121.7
o
116.6
o
1.33 Å
1.08 Å
http://hhud.tvu.edu.vn

4
II. Hệ
danh
pháp
II.1. Tên
thông
thường
•Tên
alkane
tương
ứng, đổiane
Æ
ylene
Ít
dùng, trừ
3 alkene
thông
dụng:
CH2
=CH2
ethylene
CH2
=CH-CH2 propylene
(CH3
)2
C=CH2
isobutylene
http://hhud.tvu.edu.vn

5
II.2. Danh
pháp
IUPAC
•Tên
alkane
tương
ứng, đổianeÆene
•Chọnmạch
carbon dài
nhất& chứaC=C làmmạch
chính
•Đánh
số
sao
cho
C=C có
chỉ
số
nhỏ
nhất
•Chỉ
số
củaC=C chọntheovị
trí
C gầnC1 nhất, viếtcách
tên
mạch
chính
1 gạch
ngang
http://hhud.tvu.edu.vn























![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)



