
HOÁ HỮU CƠ 1
H D CỆ ƯỢ
Ch ng 1:ươ
C u trúc đi n t c a nguyên t cacbon và s ấ ệ ử ủ ử ự
hình thành liên k t trong hoá h u cế ữ ơ
1. C u trúc đi n t c a cacbonấ ệ ử ủ
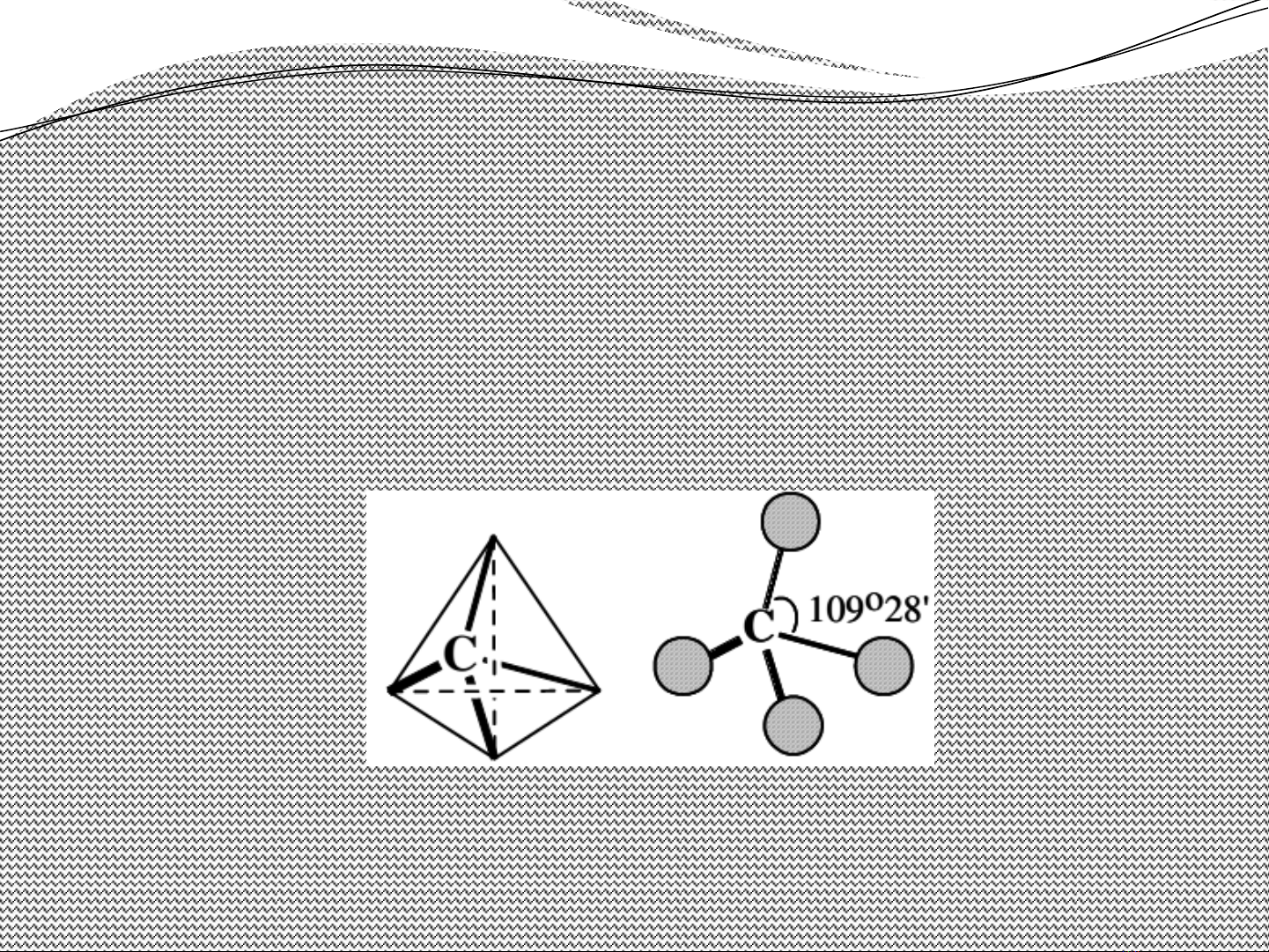
•Thuy t cacbon t di n (Vant Hoff – Le Bel 1874)ế ứ ệ
Nguyên t cacbon có hoá tr 4. B n hoá tr c a cacbon ử ị ố ị ủ
h ng ra b n đnh c a t di n, tâm t di n là nguyên t ướ ố ỉ ủ ứ ệ ứ ệ ử
cacbon
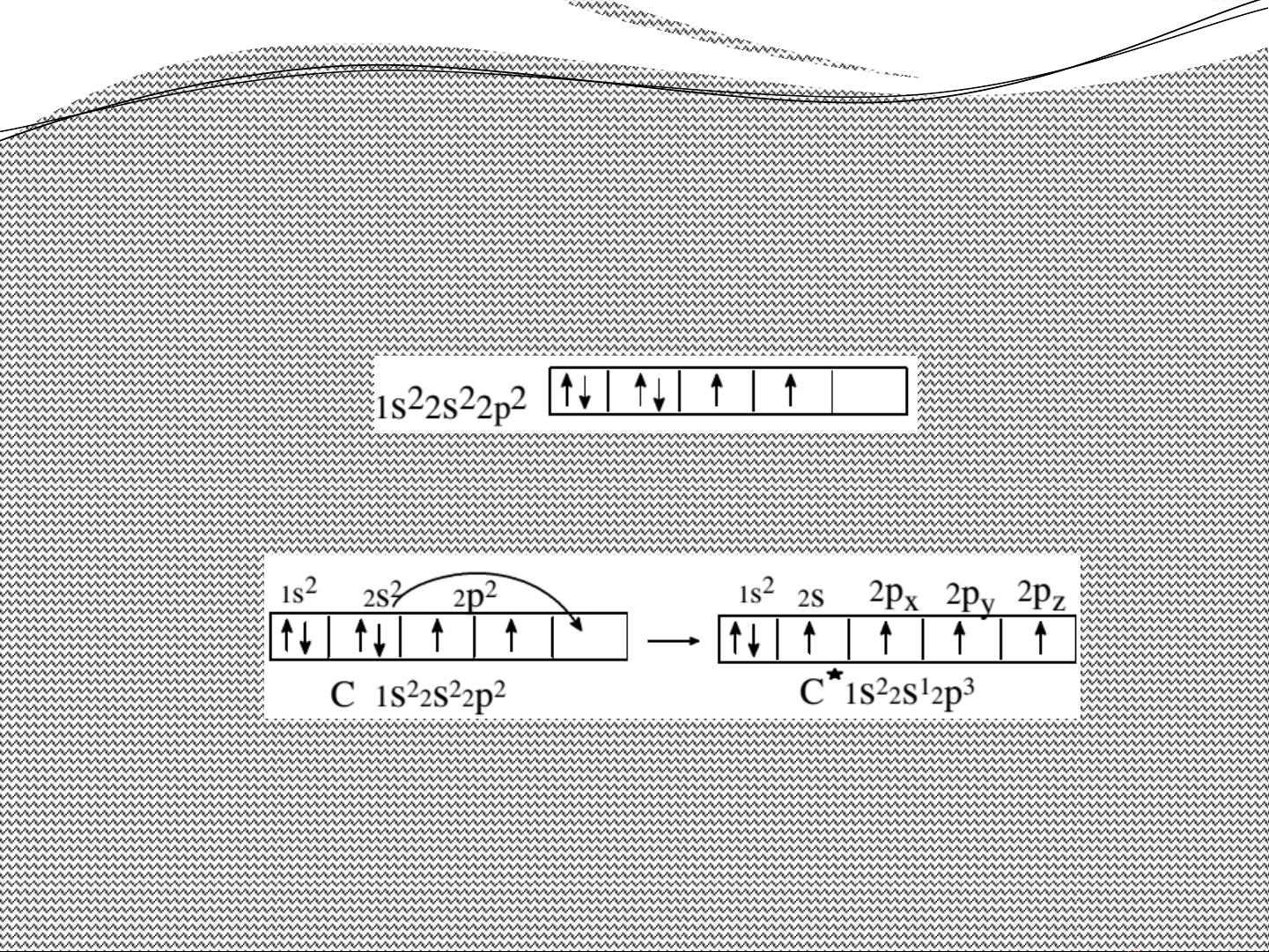
•C u trúc đi n t c a cacbonấ ệ ử ủ
Tr ng thái c b n: ạ ơ ả
C (Z=6): 1s22s22p2.
Tr ng thái kích thích: ạ
Tr ng thái kích thích, cacbon có 4e đc thân t o 4 li ên ạ ộ ạ
k t đn, cacbon luôn có hoá tr 4. ế ơ ị
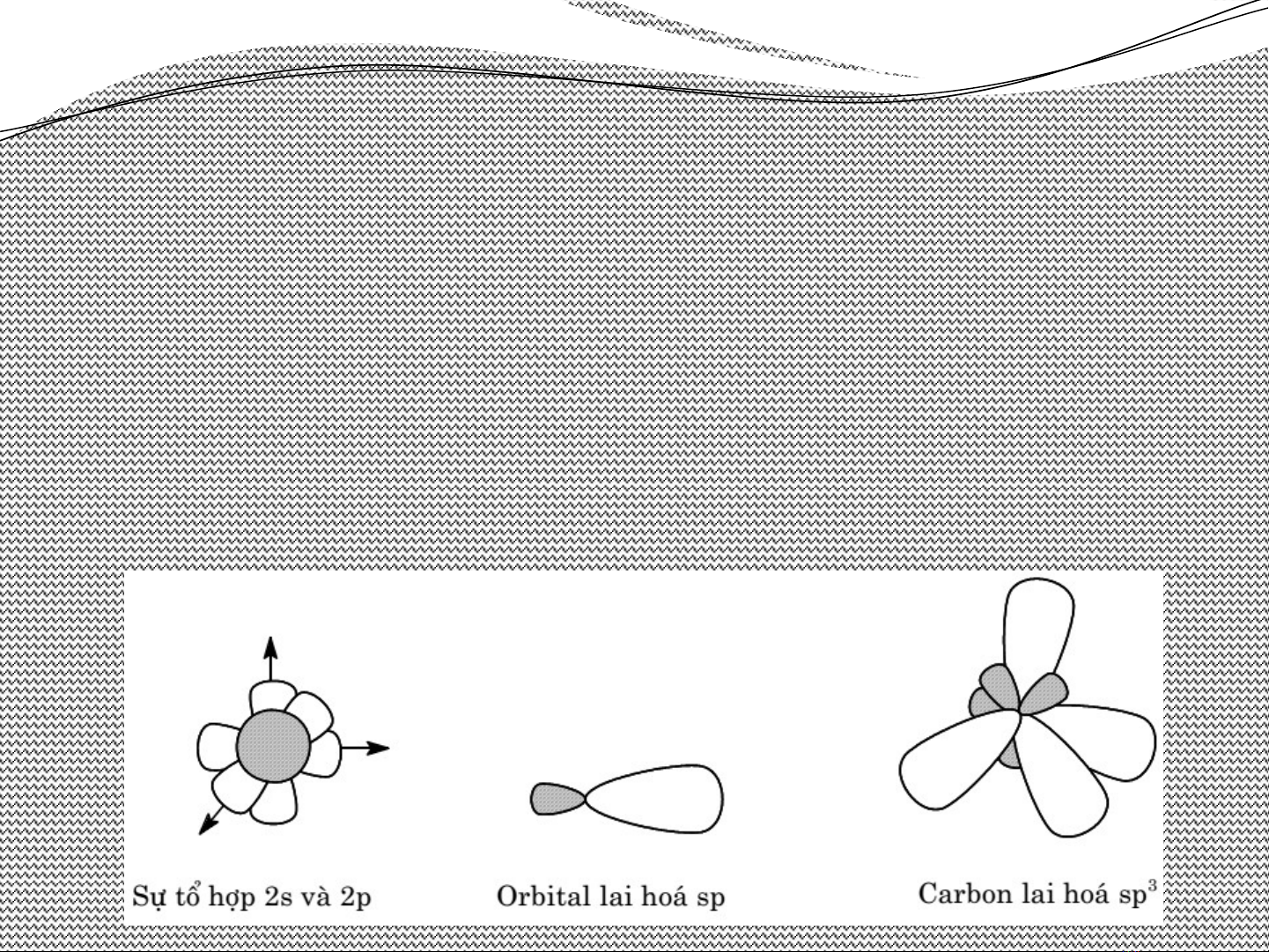
•Tr ng thái lai hoáạ
K/n: t h p các orbital có năng l ng g n b ng nhau đ ổ ợ ượ ầ ằ ể
t o các orbital có cùng năng l ng, hình d ng, kích ạ ượ ạ
th c nh ng có đnh h ng khác nhau trong không gian ướ ư ị ướ
g i là s lai hoáọ ự
Lai hoá sp3 (lai hoá t di n): 1AOs và 3AOp lai hoá v i ứ ệ ớ
nhau t o thành 4AO lai hoá spạ3


























