
1
CH NG 4ƯƠ
DUNG D CH Ị
ĐI N LYỆ
2
N i dungộ
4.1. Tính b t th ng c a dung d ch đi n lyấ ườ ủ ị ệ
4.2. Thuy t đi n lyế ệ
4.3. Đ đi n ly – H ng s đi n lyộ ệ ằ ố ệ
4.4. S solvat hóa các ionự
4.5. Ho t đ và h s ho t đạ ộ ệ ố ạ ộ
4.6. L c ionự
3
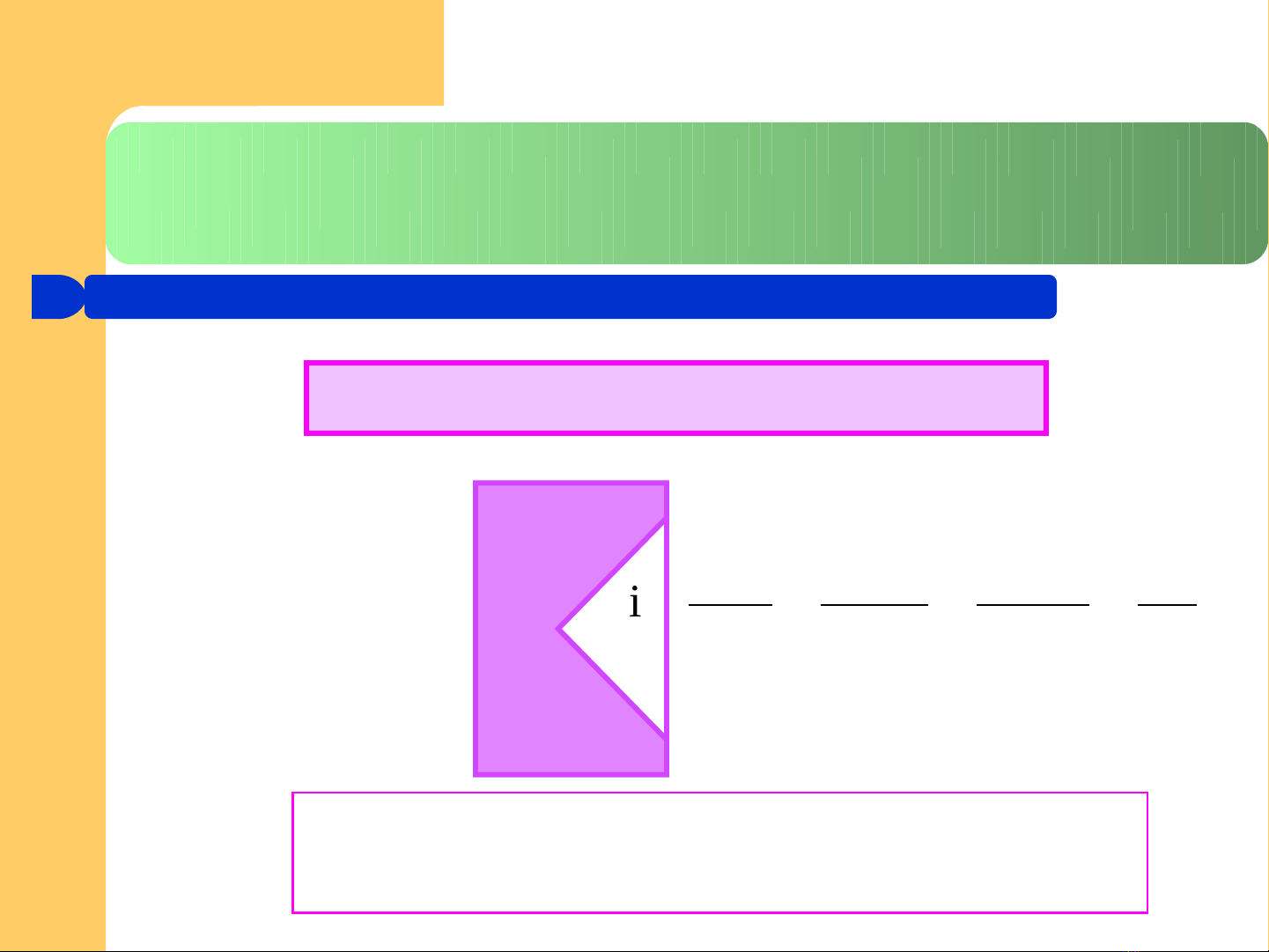
4.1. Tính b t th ng c a dung d ch đi n lyấ ườ ủ ị ệ
Th c nghi mự ệ Lý thuy tế
P
Tđ
Ts
ACID – BAZ – MU IỐ
Phát hi n – Đi u ch nhệ ề ỉ
Arrhenius Van’t Hoff
4
m
C.K.iT
=∆
i.C.R.Tπ
=
lt
tn
ltD,
tnD,
ltS,
tnS,
lt
tn
π
π
ΔT
ΔT
ΔT
ΔT
ΔP
ΔP
i
====
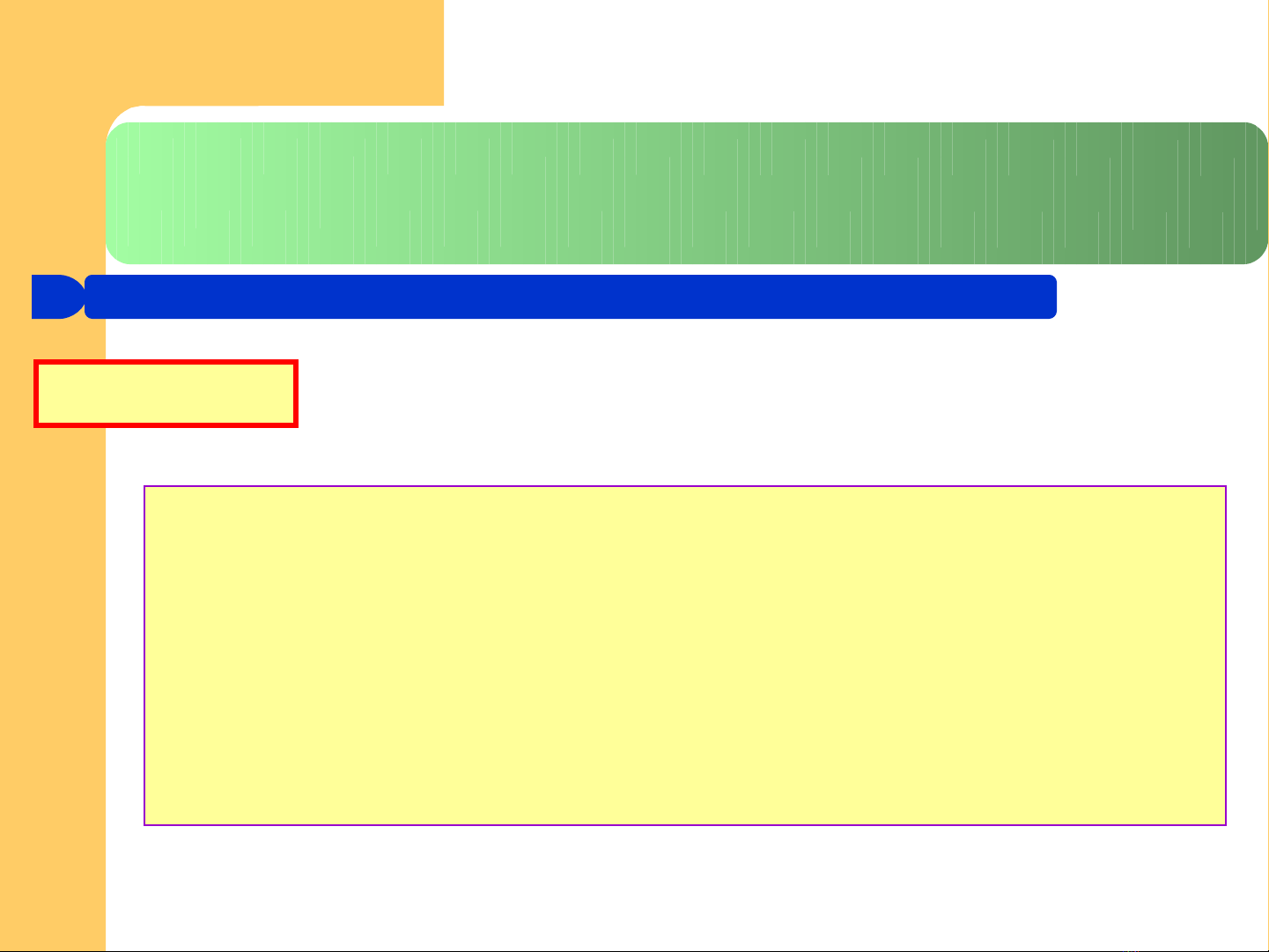
4.1. Tính b t th ng c a dung d ch đi n lyấ ườ ủ ị ệ
Øi ph thu c vào b n ch t và n ng đ ch t tanụ ộ ả ấ ồ ộ ấ
ØTrong dung d ch loãng, có giá tr t 2 – 4ị ị ừ
H s đi u ch nh ệ ố ề ỉ i - Van’t Hoff
5
Dung d ch ch a 7,308g NaCl trong 250g n c cho bi t ị ứ ướ ế
291K áp su t th m th u c a dung d ch là 2,1079.106 ở ấ ẩ ấ ủ ị
N/m2, kh i l ng riêng c a dung d ch là 1 g/cm3, h ng ố ượ ủ ị ằ
s nghi m l nh c a n c 1,86. Xác đ nh nhi t đ k t ố ệ ạ ủ ướ ị ệ ộ ế
tinh c a dung d ch?ủ ị
Bài t p 1ậ
4.1. Tính b t th ng c a dung d ch đi n lyấ ườ ủ ị ệ

![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)



![Bài giảng Nhiệt động lực học hóa học [chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20241106/vipanly/135x160/371730886770.jpg)






![Tài liệu Hướng dẫn thực tập môn Hóa nước [Chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/kimphuong1001/135x160/22661767942303.jpg)
![Đề cương ôn tập Hóa sinh [chuẩn nhất/chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/tomhum321/135x160/93461767773134.jpg)











