
CÔNG NGHỆ SINH HỌC PHÂN TỬ

CÔNG NGHỆ ADN TÁI TỔ HỢP
•Tách chiết phân tách AND ngoại lai từ sinh vật đích
•Phản ứng nối AND – vector tạo phân tử AND TTH
•Chuyển AND TTH vào tế bào chủ
•Chọn lọc các tế bào mang AND TTH
•Sản xuất, tinh sạch protein
Các bước cơ bản tạo ADNtái tổ hợp

•Endonuclease giới hạn (RE)
CÔNG NGHỆ ADN TÁI TỔ HỢP

CÔNG NGHỆ ADN TÁI TỔ HỢP
•Vector plasmid
•Vector thực khuẩn thể
lambda
•Cosmid
•BAC
•YAC
Vector nhân dòng 1. Vector plasmid

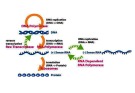
Thao tác biểu hiện ở sinh vật nhân sơ
Biểu hiện gen ở các promoter mạnh và có thể điều
chỉnh
oPromoter mạnh
•Có ái lực cao với ARN – pol vùng nằm ngay sau nó được phiên mã
thường xuyên
•Tối ưu hóa sự biểu hiện của gen nhân dòng
•Khó khăn:
Kiệt quệ năng lượng của tế bào chủsuy yếu các chức năng cần thiết
oPromoter có thể điều chỉnh
•Chỉ biểu hiện gen nhân dòng trong giai đoạn sinh trưởng đặc biệt của tế
bào chủ
•Chỉ biểu hiện trong một thời gian xác định










![Giáo trình Vi sinh vật học môi trường Phần 1: [Thêm thông tin chi tiết nếu có để tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251015/khanhchi0906/135x160/45461768548101.jpg)





![Bài giảng Sinh học đại cương: Sinh thái học [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/oursky02/135x160/99371768295754.jpg)



![Đề cương ôn tập cuối kì môn Sinh học tế bào [Năm học mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260106/hoang52006/135x160/1251767755234.jpg)

![Cẩm Nang An Toàn Sinh Học Phòng Xét Nghiệm (Ấn Bản 4) [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251225/tangtuy08/135x160/61761766722917.jpg)

