I. HÌNH THỨC KIỂM TRA:
Trắc nghiệm khách quan nhiều lựa chọn 45% + Trắc nghiệm đúng sai 40% + Trắc nghiệm trả lời ngắn
15%.
II. THỜI GIAN LÀM BÀI : 45 phút.
III. NỘI DUNG
1. Lý thuyết
1.1 Nguyên tử:
A. Thành phần, kích thước và khối lượng nguyên tử.
B. Hạt nhân nguyên tử, nguyên tố hóa học, đồng vị, nguyên tử khối trung bình.
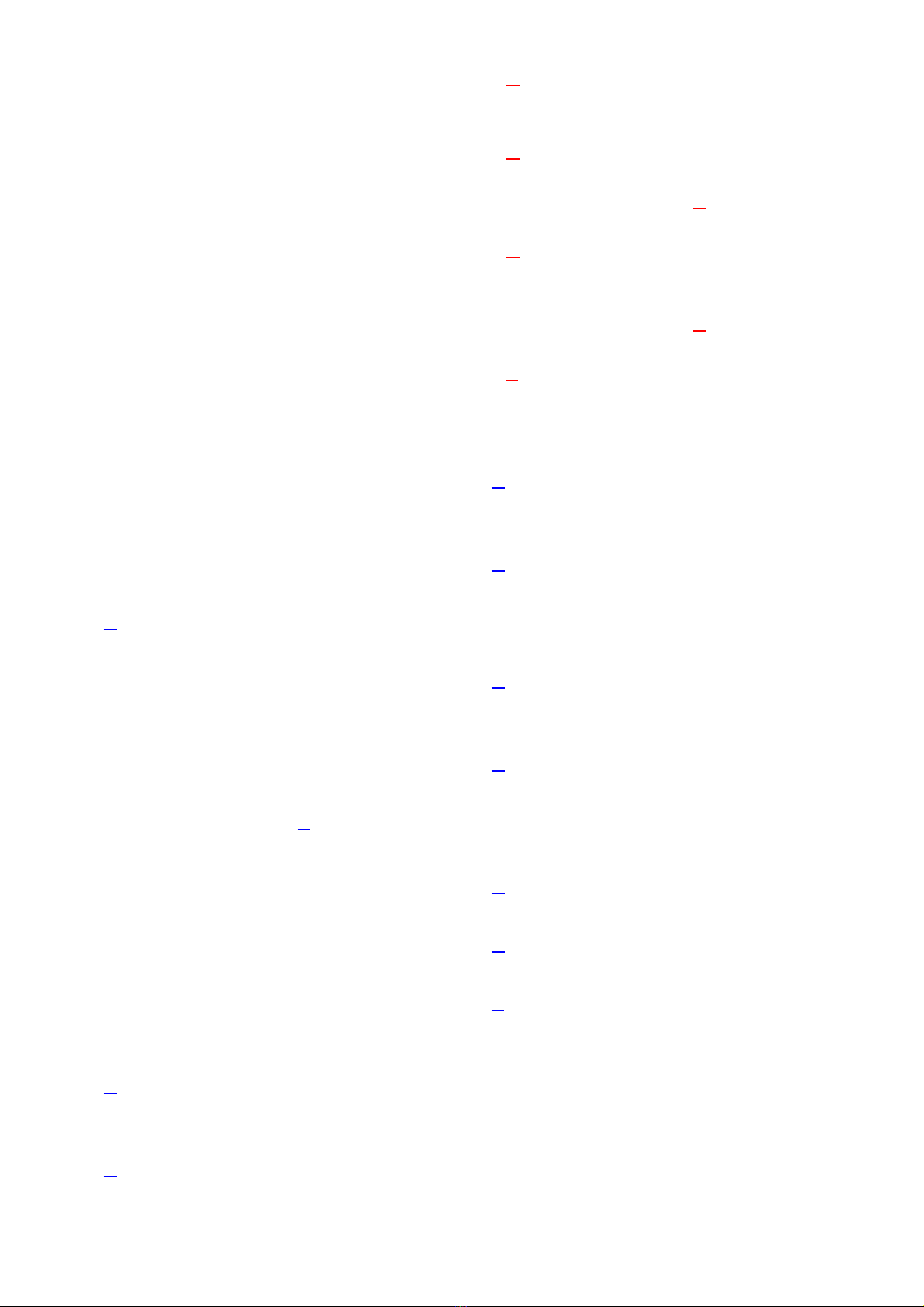
Z = số p = số e; A = Z + N
Đối với 82 nguyên tố đầu trong bảng tuần hoàn ta luôn có:
1
N
Z
1,5
C. Lớp và phân lớp electron.
D. Cấu hình electron nguyên tử.
E. Đặc điểm của lớp electron ngoài cùng.
1.2 Bảng tuần hoàn các nguyên tố hóa học.
A. Nguyên tắc xây dựng bảng tuân hoàn.
B. Câu trúc bảng tuần hoàn
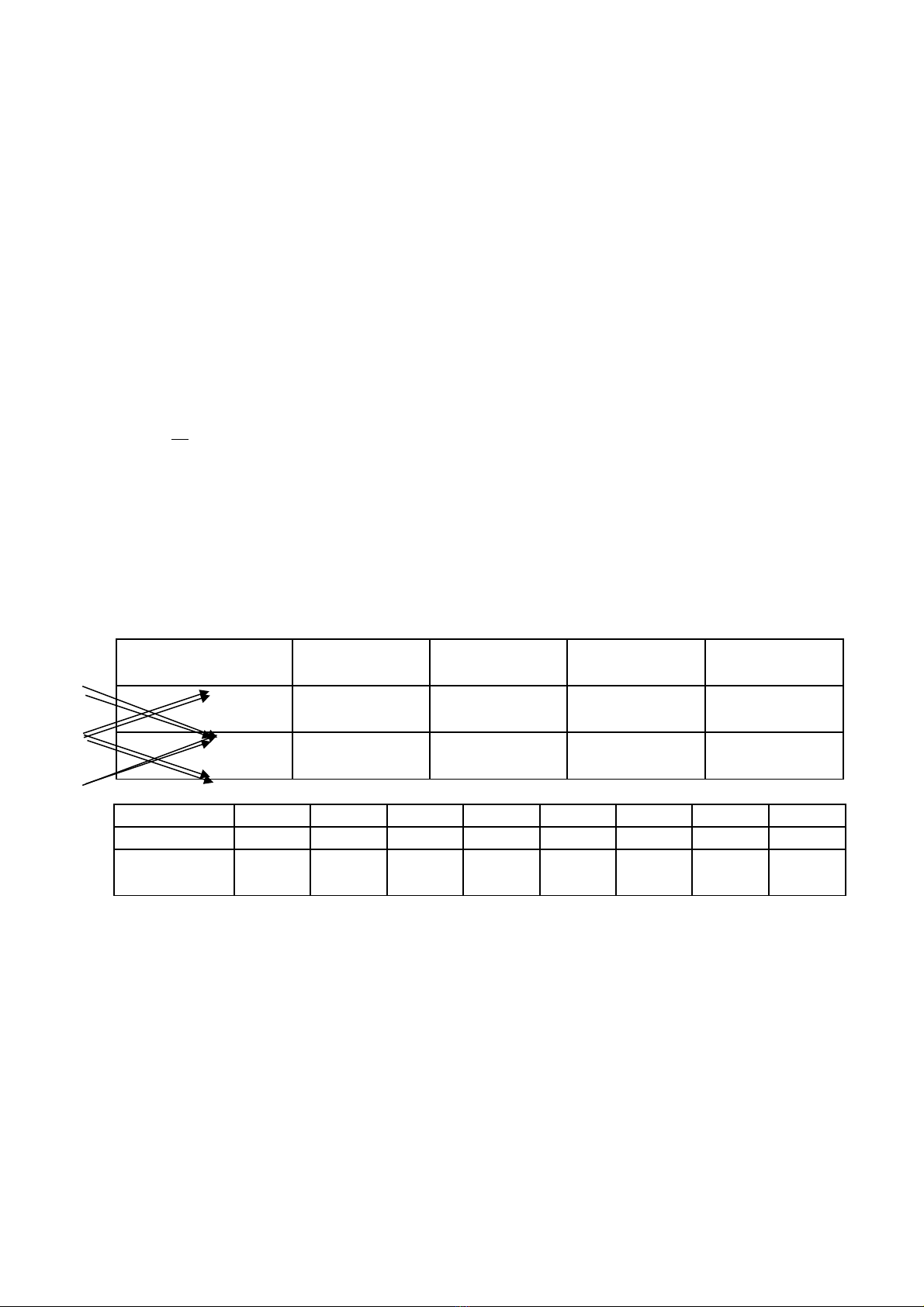
C. Chiều biến thiên cấu tạo và tính chất của các nguyên tố và hợp chất của chúng.
Bán kính
nguyên tử (r)
Độ âm điện Tính kim loại Tính phi kim
Chu kỳ(trái qua
phải)
Nhóm A(trên xuống
dưới)
Nhóm I II III IV V VI VII VIII
Oxit cao nhất R2O RO R2O3RO2R2O5RO3R2O7RO4
Hợp chất với
hiđro
RH
Rắn
RH2
Rắn
RH3
Rắn
RH4
khí
RH3
khí
RH2
Khí
RH
Khí
2. Một số dạng bài tập lí thuyết và tính toán cần lưu ý
Dạng 1: Xác định nguyên tố dựa vào số hạt
Dạng 2: Xác định thành phần nguyên tử
Dạng 3: Cách viết cấu hình electron
Dạng 4: Bài tập lớp và phân lớp
Dạng 5: Tính phần trăm đồng vị, tính nguyên tử khối trung bình
Dạng 6: Trắc nghiệm lý thuyết về nguyên tử
Dạng 7: Tính kích thước, khối lượng, khối lượng riêng, bán kính nguyên tử
1
TRƯỜNG THPT SƠN ĐỘNG SỐ 3
NHÓM HÓA
ĐỀ CƯƠNG ÔN TẬP KIỂM TRA GIỮA HỌC KỲ 1
Môn: HÓA HỌC 10
Năm học: 2024 – 2025