Trang 1/13 - Mã đề 001
TRƯỜNG TRUNG HỌC PHỔ THÔNG
NGÔ QUYỀN
TỔ HÓA HỌC- SINH HỌC
ĐỀ CƯƠNG ÔN TẬP
KIỂM TRA GIỮA KÌ 1 NĂM HỌC 2024 - 2025
Môn: Hóa học - Lớp 11
Thời gian làm bài: 45 phút (không tính thời gian phát đề)
I. Cấu trúc đề kiểm tra giữa kỳ và cuối kỳ
1. Hình thức:
Trắc nghiệm nhiều hình thức khác nhau
2. Cấu trúc đề kiểm tra
- Phần I: Câu trắc nghiệm nhiều phương án lựa chọn (18 câu – 4,5 điểm)
- Phần II: Câu trắc nghiệm đúng sai (4 câu - 4 điểm)
- Phần III: Câu trắc nghiệm trả lời ngắn (3 câu - 1,5 điểm)
II. Ma trận
Ghi chú: NLC – Câu trắc nghiệm nhiều lựa chọn; Đ/S - Câu trắc nghiệm đúng/sai; TLN – Câu trắc nghiệm trả
lời ngắn, (*) Lệnh hỏi trắc nghiệm đúng/sai (**) Lệnh hỏi trắc nghiệm trả lời ngắn
Loại câu hỏi trắc nghiệm
Số lệnh
hỏi
Biết
Hiểu
Vận dụng
Nhiều lựa chọn
18
16
2
0
Đúng/sai
16
0
12
4
Trả lời ngắn
3
0
0
3
Tổng số lệnh hỏi
37
16
14
7
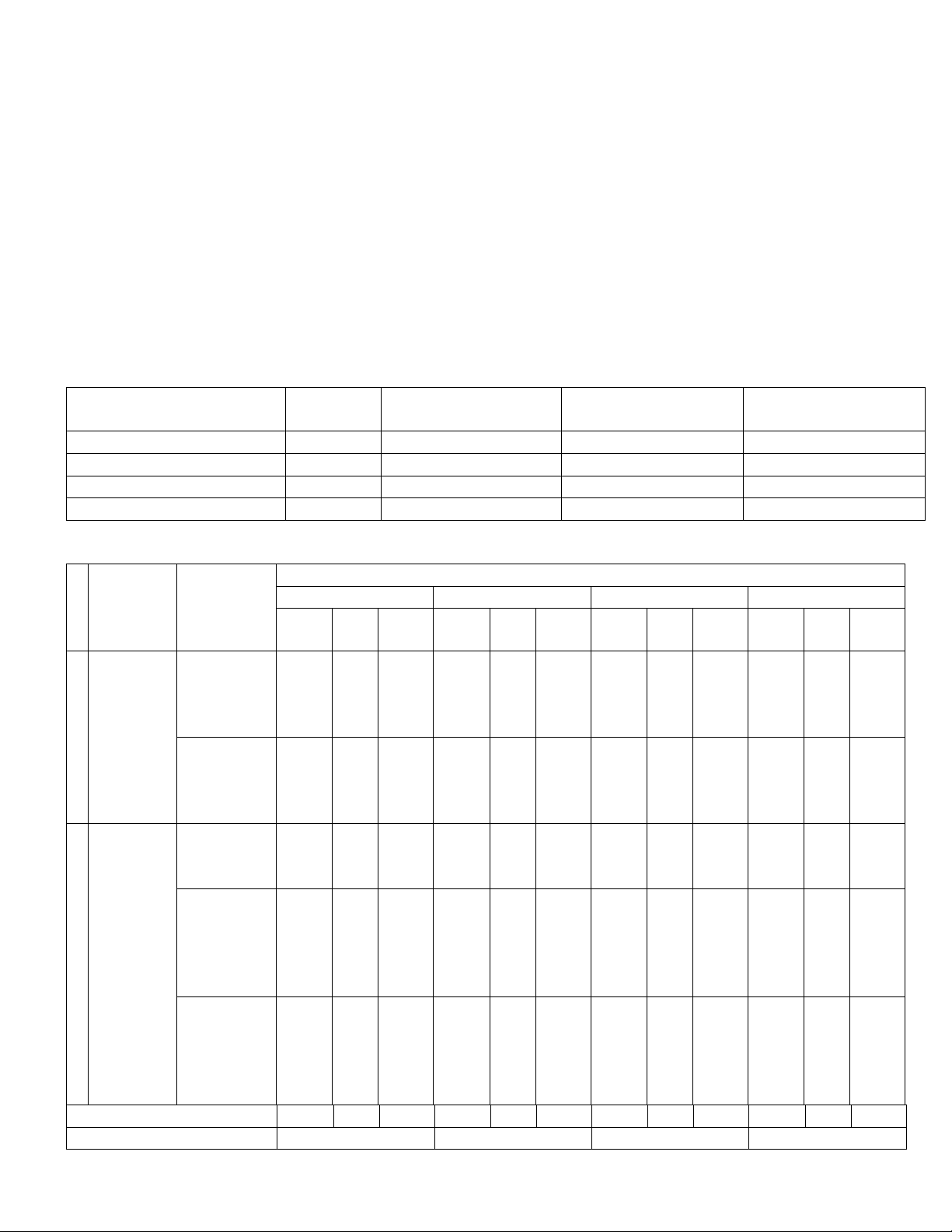
MA TRẬN KIỂM TRA GIỮA KỲ I – LỚP 11
T
T
Chủ đề
Nội
dung/đơn
v kiến
thức
Mức độ nhận thức
Nhận biết
Thông hiểu
Vận dụng
Tổng
NLC
Đ/S
TLN
NLC
Đ/S
TLN
NLC
Đ/S
TLN
NLC
Đ/S
TLN
1
Cân
bằng
ho học
1. Khái
niệm về
cân bằng
hoá học
3
2. Cân
bằng trong
dung dịch
nước.
6
1
3*
1*
1**
2
Chương
2.
Nitrogen
- Sulfur
3. Đơn
chất nitơ
(nitrogen)
1
3*
1*
4.
Ammonia
và một số
hp chất
ammonium
5
1
3*
1*
1**
5. Một số
hp chất
với oxygen
của
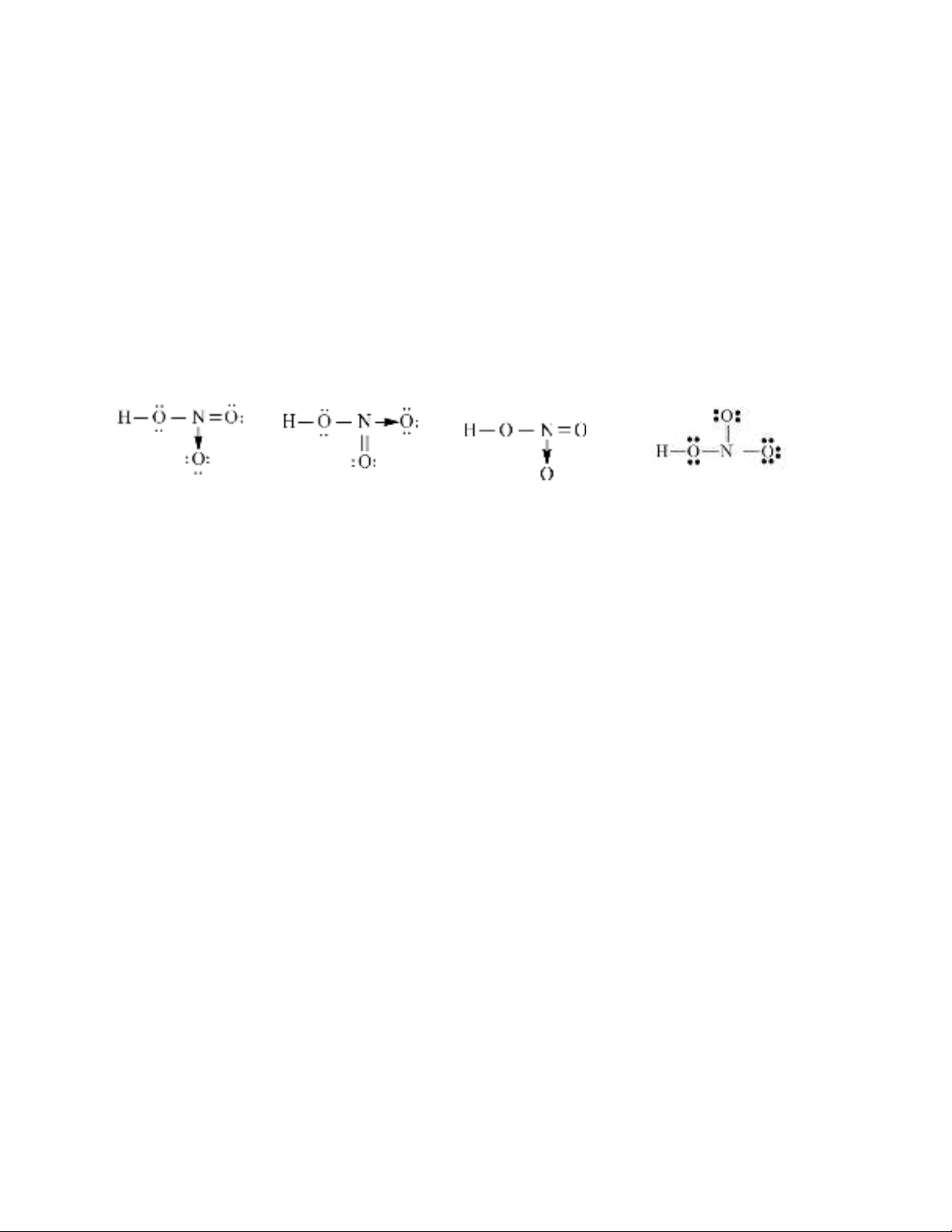
nitrogen.
1
3*
1*
1**
Tổng Số câu
16
2
12
4
3
18
16
3
Tỉ lệ %
43,2%
37,8%
18,9%
100%