B GIÁO D C VÀ ĐÀO T OỘ Ụ Ạ
(Đ thi có 05 trang)ề
Đ THI THU VÀO Đ I H C, CAO Đ NG 2010Ề Ạ Ọ Ẳ
Môn thi: HÓA H C – 17.4.2010Ọ
Th i gian làm bài: 90 phút (không k th i gian giao đ )ờ ể ờ ề
PH N CHUNG: Ầ(44 câu – t câu 1 đ n câu 44)ừ ế
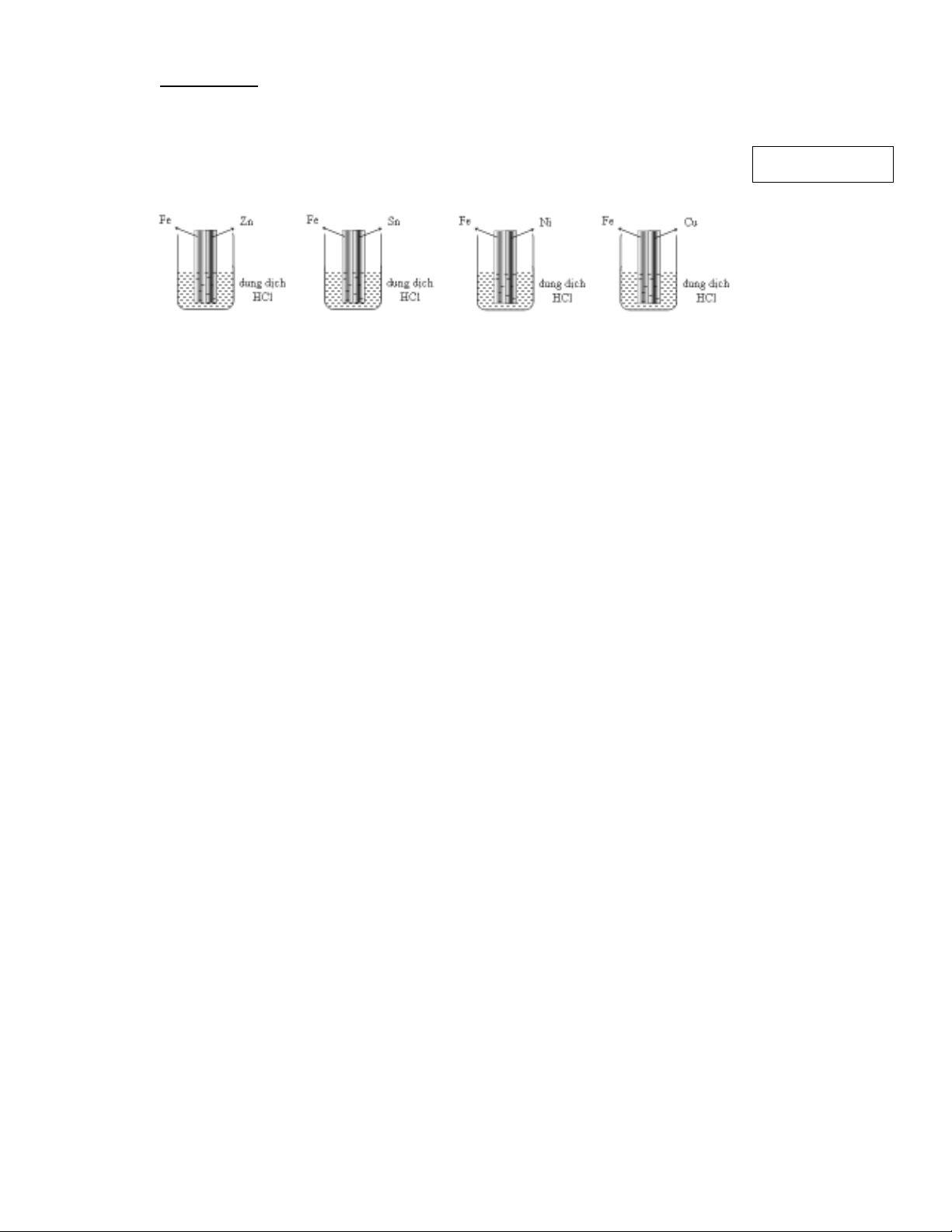
1. Có b n thanh s t đ c đ t ti p xúc v i nh ng kim lo i khác nhau và nhúng trong các dung d ch HCl nh hình v d i đâyố ắ ượ ặ ế ớ ữ ạ ị ư ẽ ướ .
Thanh s t b hòa tan ch m nh t s là thanh đ c đ t ti p xúc v i :ắ ị ậ ấ ẽ ượ ặ ế ớ
A. Zn. B. Sn. C. Ni. D. Cu.
2. Kim lo i nào sau đây có th đ y s t ra kh i dung d ch mu i Fe(NOạ ể ẩ ắ ỏ ị ố 3)3 ?
A. Ni B. Sn C. Zn D. Cu
3. Cho 27,4g bari kim lo i vào dung d ch ch a 0,1 mol CuSOạ ị ứ 4. Khi ph n ng ả ứ
x y ra hoàn toàn thì kh i l ng k t t a thu đ c b ng :ả ố ượ ế ủ ượ ằ
A. 9,8 gam. B. 23,3 gam. C. 33,1 gam. D. 46,6 gam.
4. Th tích Hể2 sinh ra (trong cùng đi u ki n) khi đi n phân hai dung d ch ch a cùng m t l ng NaCl có màng ngăn (1)ề ệ ệ ị ứ ộ ượ
và không có màng ngăn (2) là :
A. b ng nhau.ằB. (2) g p đôi (1).ấC. (1) g p đôi (2).ấD. không xác đ nh.ị
5. Dung d ch nào d i đây không th làm đ i màu quỳ tím ?ị ướ ể ổ
A. NaOH B. NaHCO3 C. Na2CO3 D. NH4Cl
6. D n V lít (đktc) khí COẫ2 qua dung d ch ch a 0,1 mol Ca(OH)ị ứ 2 thu đ c 6 gam k t t a. L c b k t t a, l y dung d chượ ế ủ ọ ỏ ế ủ ấ ị
n c l c đun nóng l i thu đ c thêm k t t a. V b ng :ướ ọ ạ ượ ế ủ ằ
A. 3,136 lít. B. 1,344 lít. C. 2,240 lít. D. 3,360 lít.
7. Nh n xét nào d i đây là đúng ?ậ ướ
A. Nhôm kim lo i có tính kh m nh h n so v i kim lo i ki m và kim lo i ki m th cùng chu kì.ạ ử ạ ơ ớ ạ ề ạ ề ổ
B. Trong ph n ng c a nhôm v i dung d ch NaOH thì NaOH đóng vai trò ch t oxi hóa.ả ứ ủ ớ ị ấ
C. Các v t d ng b ng nhôm không b oxi hóa ti p và không tan trong n c do đ c b o v b i l p màng Alậ ụ ằ ị ế ướ ượ ả ệ ở ớ 2O3.
D. Do có tính kh m nh nên nhôm ph n ng v i các axit HCl, HNOử ạ ả ứ ớ 3, H2SO4 trong m i đi u ki n.ọ ề ệ
8. Xét ph n ng : Al + HNOả ứ 3 → Al(NO3)3 + N2O + H2O. L ng HNOượ 3 c n đ tác d ng v a đ v i 0,04 mol Al là : ầ ể ụ ừ ủ ớ
A. 0,150 mol. B. 0,015 mol. C. 0,180 mol. D. 0,040 mol.
9. Đ hòa tan cùng m t l ng Fe, thì s mol HCl (1) và s mol Hể ộ ượ ố ố 2SO4 (2) trong dung d ch loãng c n dùng là :ị ầ
A. (1) b ng (2).ằB. (1) g p đôi (2).ấC. (2) g p đôi (1).ấD. (1) g p ba (2).ấ
10. Hi n t ng nào d i đây đ c mô t ệ ượ ướ ượ ả không đúng ?
A. Thêm NaOH vào dung d ch FeClị3 màu vàng nâu th y xu t hi n k t t a đ nâu.ấ ấ ệ ế ủ ỏ
B. Thêm m t ít b t Fe vào l ng d dung d ch AgNOộ ộ ượ ư ị 3 th y hình thành dung d ch có màu xanh nh t. ấ ị ạ
C. Thêm Fe(OH)3 màu đ nâu vào dung d ch Hỏ ị 2SO4 th y hình thành dung d ch có màu vàng nâu.ấ ị
D. Thêm Cu vào dung d ch Fe(NOị3)3 th y dung d ch chuy n t màu vàng nâu sang màu xanh.ấ ị ể ừ
11. Hòa tan 2,16 gam FeO trong l ng d dung d ch HNOượ ư ị 3 loãng thu đ c V lít (đktc) khí NO duy nh t. V b ng :ượ ấ ằ
A. 0,224 L. B. 0,336 L. C. 0,448 L. D. 2,240 L.
12. Nh n xét nào d i đây là ậ ướ không đúng ?
A. Axit flohiđric đ c dùng đ kh c ch lên th y tinh do ph n ng : SiOượ ể ắ ữ ủ ả ứ 2 + 4HF → SiH4 + 2F2O
B. AgBr tr c đây đ c dùng đ ch t o phim nh do ph n ng : 2AgBr ướ ượ ể ế ạ ả ả ứ
as
→
2Ag + Br2
C. N c Gia - ven có tính oxi hóa m nh là do t o đ c HClO theo ph n ng :ướ ạ ạ ượ ả ứ
NaClO + CO2 + H2O → NaHCO3 + HClO
D. KClO3 đ c dùng đ đi u ch Oượ ể ề ế 2 trong phòng thí nghi m theo ph n ng : 2KClOệ ả ứ 3
2
M nO ,t
→
2KCl + 3O2
1
Mã đ thi 407ề

13. Hòa tan 0,3 mol Cu vào l ng d dung d ch loãng ch a h n h p g m NaNOượ ư ị ứ ỗ ợ ồ 3 và H2SO4 thì :
A. ph n ng không x y ra. ả ứ ả B. ph n ng x y ra t o 0,3 mol NO. ả ứ ả ạ
C. ph n ng x y ra t o 0,2 mol NO.ả ứ ả ạ D. ph n ng x y ra t o 0,6 mol NOả ứ ả ạ 2.
14. Trong s n ph m ph n ng monoclo hóa metan, ả ẩ ả ứ không có ch t sau :ấ
A. CH3Cl. B. HCl. C. CH3CH3.D. H2.
15. Quá trình nào d i đây đ c s d ng đ đi u ch m t thu c n thông d ng ?ướ ượ ử ụ ể ề ế ộ ố ổ ụ
A. C6H6
3 2 4
H N O /H SO
→
A
3 3
CH Cl/A lCl
→
BB. n-C7H16
xt,t,p
→
A
3 2 4
H N O /H SO
→
B
C. n-C6H14
xt,t,p
→
A
o
2
Cl ,as,50 C
→
BD. C2H2
o
C,600 C
→
A
3 2 4
H N O /H SO
→
B
16. Mô t nào d i đây ả ướ không hoàn toàn đúng v i glucoz ?ớ ơ
A. Ch t r n, màu tr ng, tan trong n c và có v ng t.ấ ắ ắ ướ ị ọ
B. Có m t trong h u h t các b ph n c a cây, nh t là trong qu chín.ặ ầ ế ộ ậ ủ ấ ả
C. Còn có tên g i là ọđ ng nhoườ .
D. Có 0,1% trong máu ng i.ườ
17. Saccaroz và mantoz s t o s n ph m gi ng nhau khi tham gia ph n ng nào d i đây ?ơ ơ ẽ ạ ả ẩ ố ả ứ ướ
A. Th y phânủB. Đ t cháy hoàn toàn ố
B. Tác d ng v i Cu(OH)ụ ớ 2D. Tác d ng v i dung d ch AgNOụ ớ ị 3 trong NH3
18. Cho dãy chuy n hóa : X ể→ tinh b t ộ→ glucoz ơ→ Y.
Các ch t X, Y l n l t có th là :ấ ầ ượ ể
X Y X Y
A. CO2C2H5OH B. C2H5OH CH3COOH
C. CH3OH CO2D. CH3CHO C2H5OH
19. Cho m t h n h p A ch a NHộ ỗ ợ ứ 3, C6H5NH2 và C6H5OH. A đ c trung hòa b i 0,02 mol NaOH ho c 0,01 mol HCl. Aượ ở ặ
cũng ph n ng v a đ v i 0,075 mol Brả ứ ừ ủ ớ 2 t o k t t a. S mol các ch t NHạ ế ủ ố ấ 3, C6H5NH2 và C6H5OH l n l t b ng:ầ ượ ằ
A. 0,01 mol; 0,005 mol và 0,02 mol B. 0,005 mol; 0,005 mol và 0,02 mol
C. 0,005 mol; 0,02 mol và 0,005 mol C. 0,01 mol; 0,005 mol và 0,02 mol
20. Cho các dãy chuy n hóa :ể
Glixin
→+NaOH
A
→+HCl
X Glixin
→+HCl
B
→+NaOH
Y. X và Y :
A. đ u là ClHề3NCH2COONa. B. l n l t là ClHầ ượ 3NCH2COOH và ClH3NCH2COONa.
C. l n l t là ClHầ ượ 3NCH2COONa và H2NCH2COONa. D. l n l t là ClHầ ượ 3NCH2COOH và H2NCH2COONa.
21. Phát bi u nào d i đây v protein là ể ướ ề không đúng ?
A. Protein (protit) là nh ng polipeptit cao phân t có kh i l ng phân t t vài ch c ngàn đ n vài tri u đvC.ữ ử ố ượ ử ừ ụ ế ệ
B. Protein (protit) có vai trò là n n t ng v c u trúc và ch c năng c a m i s s ng.ề ả ề ấ ứ ủ ọ ự ố
C. Protein (protit) đ n gi n ơ ả là nh ng protein đ c t o thành ch t các g c α- và ữ ượ ạ ỉ ừ ố β-amino axit.
D. Protein (protit) ph c t p ứ ạ là nh ng protein đ c t o thành t protein đ n gi n và lipit, gluxit, axit nucleic,...ữ ượ ạ ừ ơ ả
22. Cho công th c : ứ
Giá tr n trong công th c này ị ứ không th g i là :ể ọ
A. h s polime hóa.ệ ố B. đ polime hóa.ộC. h s trùng h p ệ ố ợ D. h s trùng ng ngệ ố ư
23. Đi n t thích h p vào ch tr ng trong đ nh nghĩa v v t li u compozit : "V t li u compozit là v t li u h n h p g mề ừ ợ ỗ ố ị ề ậ ệ ậ ệ ậ ệ ỗ ợ ồ
ít nh t ... ấ(1)... thành ph n v t li u phân tán vào nhau mà ...(2)...ầ ậ ệ
A. (1) hai; (2) không tan vào nhau B. (1) hai; (2) tan vào nhau
C. (1) ba; (2) không tan vào nhau D. (1) ba; (2) tan vào nhau
24. Tìm t thích h p cho các kho ng tr ng trong đ nh nghĩa : “ừ ợ ả ố ị Ancol là nh ng h p ch t h u c có nhóm .....(1)..... liênữ ợ ấ ữ ơ
k t tr c ti p v i nguyên t .....(2).....ế ự ế ớ ử ”.
(1) (2) (1) (2)
A. hiđroxyl cacbon no B. hiđroxyl cacbon ch a noư
C. cacbonyl cacbon ch a noưD. cacboxyl cacbon no
25. Có các h p ch t h u c : CHợ ấ ữ ơ 3CH2Cl, CH3OCH3, CH2CH2OH và n-C4H9OH. Ch t tan t t nh t trong n c là :ấ ố ấ ướ
A. CH3CH2Cl. B. CH3OCH3.C. CH3CH2OH. D. n-C4H9OH.
26. Phân t h p ch t nào d i đây có H kém linh đ ng nh t ?ử ợ ấ ướ ộ ấ
2
NH[CH
2
]
6
CO n
A. H2OB. CH3CH2OH C. C6H5OH D. H2O + CO2
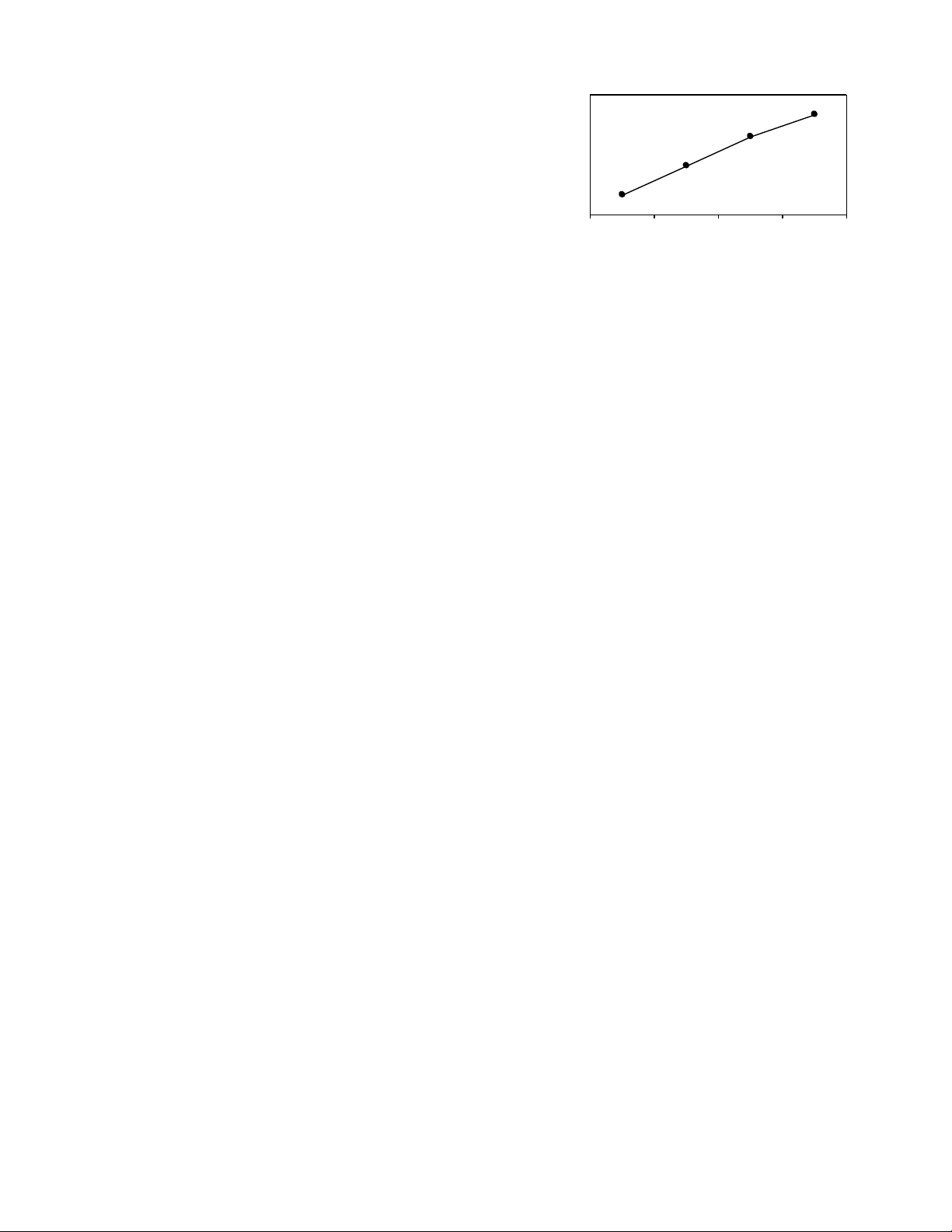
27. D i đây là gi n đ nhi t đ sôi c a m t s h p ch t h u c :ướ ả ồ ệ ộ ủ ộ ố ợ ấ ữ ơ
20
49
78,3
100,5
etanal pr opanal e tanol m etanoic
N hi
ệt
độ s«i (
o
C )
Nh n đ nh nào d i đây là ậ ị ướ không đúng ?
A. Nhi t đ sôi c a propanal l n h n c a etanal, do kh i l ng phân t propanal l n h n etanal.ệ ộ ủ ớ ơ ủ ố ượ ử ớ ơ
B. Nhi t đ sôi c a etanol l n h n c a propanal, do liên k t hiđro liên phân t c a ancol b n h n liên k t hiđro liênệ ộ ủ ớ ơ ủ ế ử ủ ề ơ ế
phân t c a anđehit. ử ủ
C. Nhi t đ sôi c a metanoic l n h n c a etanol do liên k t hiđro liên phân t c a axit cacboxylic b n h n liên k tệ ộ ủ ớ ơ ủ ế ử ủ ề ơ ế
hiđro liên phân t c a ancol.ử ủ
D. Nhìn chung các anđehit đ u có nhi t đ sôi th p h n các ancol và axit cacboxylic có kh i l ng phân t t ng đ ng. ề ệ ộ ấ ơ ố ượ ử ươ ươ
28. Tr ng h p nào d i đây có s phù h p gi a dãy đ ng đ ng và công th c chung c a nó ?ườ ợ ướ ự ợ ữ ồ ẳ ứ ủ
ch tấcông th c chungứch tấcông th c chungứ
A. ankanoic CnH2n+1COOH hay CxH2xO B. ankanoic CnH2n+1COOH hay CxH2xO
C. ankenoic CnH2n-1COOH hay CxH2x-2O2 D. ankenoic CnH2n-1COOH hay CxH2x-2O2
29. Cho lên men gi m 1 L ancol etylic 8ấo. Bi t kh i l ng riêng c a ancol etylic là 8 g/mL, hi u su t ph n ng là 100%ế ố ượ ủ ệ ấ ả ứ
và oxi chi m 20% th tích không khí. Th tích không khí (đktc) c n đ th c hi n quá trình lên men b ng :ế ể ể ầ ể ự ệ ằ
A. ≈ 62 L. B. ≈ 312 L. C. ≈ 1560 L. D. ≈ 2434 L.
30. Este X là d n xu t c a benzen có công th c phân t là Cẫ ấ ủ ứ ử 9H8O2; X tác d ng v i xút cho hai mu i và n c, các mu iụ ớ ố ướ ố
đ u có kh i l ng phân t l n h n kh i l ng phân t c a natri axetat. Công th c c u t o c a X là :ề ố ượ ử ớ ơ ố ượ ử ủ ứ ấ ạ ủ
A. HCOOC6H4CH=CH2.B. CH2=CHCOOC6H5. C. CH3COOC6H4CH=CH2.D. C6H5COOCH=CH2.
31. Xà phòng hóa hoàn toàn m t trieste X b ng dung d ch NaOH thu đ c ộ ằ ị ượ 9,2 gam glixerin (glixerol) và 83,4 gam mu i c aố ủ
m t axit béo no B. Ch t B là :ộ ấ
A. axit axetic. B. axit panmitic. C. axit oleic. D. axit stearic.
32. Đun nóng NH3 trong bình kín không có không khí m t th i gian, r i đ a v nhi t đ ban đ u thì th y áp su t trongộ ờ ồ ư ề ệ ộ ầ ấ ấ
bình tăng g p 1,5 l n. V y % NHấ ầ ậ 3 đã b phân h y trong th i gian này b ng :ị ủ ờ ằ
A. 25%. B. 50%. C. 75%. D. 100%.
33. Giá tr pH c a dung d ch CHị ủ ị 3COONa 0,1M (có đ đi n li α = 1,34%) là :ộ ệ
A. 1,9. B. 2,9. C. 12,1. D. 11,1.
34. Hòa tan 11 gam h n h p Al và Fe trong dung d ch Hỗ ợ ị 2SO4 loãng thu đ c 8,96 L khí (đktc). N u hòa tan 5,5 gam h nượ ế ỗ
h p này trong dung d ch Hợ ị 2SO4 đ c nóng d , thì l ng khí thu đ c (đktc) b ng :ặ ư ượ ượ ằ
A. 2,016 L. B. 3,584 L. C. 4,368 L. D. 8,376 L.
35. Đ t cháy hoàn toàn h n h p ch a 0,1 mol Fe và 0,1 mol FeS th y t o thành m t s n ph m r n duy nh t. S mol Oố ỗ ợ ứ ấ ạ ộ ả ẩ ắ ấ ố 2
đã s d ng b ng :ử ụ ằ
A. 0,25 mol. B. 0,23 mol. C. 0,20 mol. D. 0,15 mol.
36. Th i m u th ch a duy nh t m t khí X (có th là m t trong b n khí : Nổ ẫ ử ứ ấ ộ ể ộ ố 2, NH3, CH4 và CO) l n l t qua CuO đ tầ ượ ố
nóng, CuSO4 khan và bình ch a dung d ch Ca(OH)ứ ị 2. Sau thí nghi m th y CuSOệ ấ 4 đ i qua màu xanh và bình ch a n cổ ứ ướ
vôi trong không có hi n t ng gì. X là :ệ ượ
A. N2.B. NH3. C. CH4. D. CO.
37. Hòa tan h t h n h p hai kim lo i A, B trong dung d ch HCl d , thêm ti p vào đó l ng d NHế ỗ ợ ạ ị ư ế ượ ư 3. L c tách k t t a,ọ ế ủ
nhi t phân k t t a, r i đi n phân nóng ch y ch t r n, thì thu đ c kim lo i A. Thêm Hệ ế ủ ồ ệ ả ấ ắ ượ ạ 2SO4 v a đ vào dung d chừ ủ ị
n c l c, r i đi n phân dung d ch thu đ c, thì sinh ra kim lo i B. A, B có th là c p kim lo i nào d i đây ?ướ ọ ồ ệ ị ượ ạ ể ặ ạ ướ
A. Al và Cu. B. Fe và Zn. C. Fe và Cu. D. Al và Zn.
38. Khi cho bay h i hoàn toàn 0,6 g ch t X đi u ki n nhi t đ và áp su t thích h p đã thu đ c m t th tích h i b ngơ ấ ở ề ệ ệ ộ ấ ợ ượ ộ ể ơ ằ
đúng th tích h i c a 0,32 g Oể ơ ủ 2 trong cùng đi u ki n. ề ệ Xác đ nh phân t kh i c a X.ị ử ố ủ
A. 30 B. 60 C. 90 D. 120
3
39. Công th c cho dãy đ ng đ ng nào d i đây ứ ồ ẳ ướ không đúng ?
h p ch t m ch hợ ấ ạ ở h p ch t m ch hợ ấ ạ ở
A. ancol no, đ n ch cơ ứ CnH2n+2 B. axit cacboxylic no, hai ch cứCnH2n - 2
C. anđehit ch a no (1 liên k tư ế
đôi), đ n ch cơ ứ CnH2n+2O2D. amin no, đ n ch c, b c nh tơ ứ ậ ấ CnH2n+2N
40. Hòa tan m gam ancol etylic (D = 0,8 g/mL) vào 108 mL n c (D = 1 g/mL) t o thành dung d ch A. Cho A tác d ngướ ạ ị ụ
v i Na d thu đ c 85,12 L (đktc) khí Hớ ư ượ 2. Dung d ch A có đ r u b ng :ị ộ ượ ằ
A. 8oB. 41o C. 46o D. 92o
41. Etilenglicol (etylen glicol) hòa tan Cu(OH)2 t o s n ph m có c u t o :ạ ả ẩ ấ ạ
A. CH
2
CH
2
O
O
H
Cu
H
O
O
CH
2
CH
2
B. CH
2
CH
2
H
O
OCu O
O
H
CH
2
CH
2
C. CH
2
CH
2
H
O
OCu
H
O
O
CH
2
CH
2
D. CH
2
CH
2
H
O
O
H
Cu
H
O
O
H
CH
2
CH
2
42. Đ phân bi t ba bình khí m t nhãn ch a CHể ệ ấ ứ 4, C2H4 và C2H2, KHÔNG nên s d ng các dung d ch thu c th (theo tr tử ụ ị ố ử ậ
t ) d i đây :ự ướ
A. KMnO4, Br2.B. AgNO3/NH3, Br2.C. Br2, AgNO3/NH3.D. AgNO3/NH3, KMnO4.
43. Đ phân bi t các ch t ể ệ ấ anđehit axetic, glixerin (glixerol), glucoz và axit axetic, ng i ta thêm Cu(OH)ơ ườ 2 trong môi
tr ng ki m, sau đó đun nóng nh . M t h c sinh đã d đoán các hi n t ng x y ra. D đoán nào ườ ề ẹ ộ ọ ự ệ ượ ả ự không đúng ?
Công th cứ Hi n t ngệ ượ Công th cứ Hi n t ngệ ượ
A. CH3CHO k t t a đ g chế ủ ỏ ạ B. C3H5(OH)3dung d ch xanh lam đ mị ậ
C. C6H12O6dung d ch xanh lam đ m, sau t oị ậ ạ
k t t a đ g chế ủ ỏ ạ D. CH3COOH không hi n t ng ệ ượ
44. Ph ng trình hoá h c nào ươ ọ không đúng ?
A.
3 2 2
2K N O 2K N O O→ +
B.
( )
t
3 2 2
2
2Fe N O 2FeO 4N O O→ + +
C.
t
3 2 2
2A gN O 2A g 2N O O→ + +
D.
( )
t
3 2 3 2 2
3
4Fe N O 2Fe O 12N O 3O→ + +
PH N RIÊNG Ầ(thí sinh ch đ c làm m t trong hai ph n: ph n I ho c ph n II)ỉ ượ ộ ầ ầ ặ ầ
Ph n I: dành cho thí sinh ch ng trình phân ban ầ ươ (6 câu- t câu 45 đ n câu 50)ừ ế
45. Hòa tan h t 1,08 gam h n h p Cr và Fe trong dung d ch HCl loãng, nóng thu đ c 448 mL khí (đktc). Kh i l ngế ỗ ợ ị ượ ố ượ
crom có trong h n h p là :ỗ ợ
A. 0,065 gam. B. 0,520 gam. C. 0,560 gam. D. 1,015 gam.
46. Kh iố l ng Cu đi u ch đ c t 1 t n pirit đ ng (ch a 60% CuFeSượ ề ế ượ ừ ấ ồ ứ 2, hi u su t quá trình b ng 90%) là :ệ ấ ằ
A. 0,54 t n.ấB. 0,31 t n.ấC. 0,21 t n.ấD. 0,19 t n.ấ
47. Ng i ta có th tách vàng ra kh i qu ng b ng ph ng pháp tuy n tr ng l c (ph ng pháp đãi) vì :ườ ể ỏ ặ ằ ươ ể ọ ự ươ
A. vàng là kim lo i y u.ạ ế B. vàng là kim lo i n ng.ạ ặ
C. t kh i c a đ t, đá, cát l n h n vàng.ỉ ố ủ ấ ớ ơ D. trong t nhiên ch có vàng t n t i d ng đ n ch t.ự ỉ ồ ạ ạ ơ ấ
48. Hòa tan h t 0,1 mol Zn vào dung d ch HNOế ị 3 thì không th y khí thoát ra. L ng HNOấ ượ 3 đã ph n ng v i l ng Zn trênả ứ ớ ượ
b ngằ :
A. 0,025 mol. B. 0,125 mol. C. 0,225 mol. D. 0,250 mol.
49. Ch dùng m t thu c th đ phân bi t các ch t d ng l ng : phenol, stiren, ancol benzylic, thì thu c th nên dùng là :ỉ ộ ố ử ể ệ ấ ạ ỏ ố ử
A. Cu(OH)2.B. Na kim lo iạ.C. dung d ch Brị2.D. dung d ch AgNOị3/NH3.
50. Axeton đ c dùng làm dung môi vì :ượ
A. có kh năng hòa tan t t nhi u ch t h u c .ả ố ề ấ ữ ơ B. có kh năng hòa tan t t nhi u ch t vô c .ả ố ề ấ ơ
C. xeton tan t t trong n cố ướ D. axeton ph n ng đ c v i n cả ứ ượ ớ ướ
Ph n II: dành cho thí sinh ch ng trình không phân ban ầ ươ (6 câu-t câu 51 đ n câu 56)ừ ế
4

51. Hòa tan 0,1 mol phèn s t – amoni (NHắ4)2SO4. Fe2(SO4)3.24H2O vào n c đ c dung d ch A. Cho đ n d dung d chướ ượ ị ế ư ị
Ba(OH)2 vào dung d ch A thì thu đ c k t t a B. Kh i l ng c a B b ng :ị ượ ế ủ ố ượ ủ ằ
A. 21,4 gam. B. 69,9 gam. C. 93,2 gam. D. 114,6 gam.
52. Cho 13,5 gam Al tác d ng v a đ v i dung d ch HNOụ ừ ủ ớ ị 3, th y thoát ra m t h n h p khí g m NO và Nấ ộ ỗ ợ ồ 2O có t kh i h iỉ ố ơ
so v i Hớ2 b ng 19,2. S mol NO có trong h n h p khí b ng :ằ ố ỗ ợ ằ
A. 0,05 mol. B. 0,10 mol. C. 0,15 mol. D. 0,20 mol.
53. Cho các ph n ng : ả ứ (1) Cu + 2Fe3+ → Cu2+ + 2Fe2+ (2) Fe + Cu2+ → Fe2+ + Cu
Ph n ng nào cho th y tính kh c a Cu m nh h n Feả ứ ấ ử ủ ạ ơ 2+ ?
A. (1) B. (2) C. c (1) và (2)ảD. không có ph n ng nàoả ứ
54. Đ t cháy hoàn toàn m gam hiđrocacbon X (là ch t khí đi u ki n th ng) thu đ c m gam Hố ấ ở ề ệ ườ ượ 2O. Hiđro hóa X (H2,
xúc tác Pd/PbCO3) t o s n ph m có đ ng phân hình h c. X là :ạ ả ẩ ồ ọ
A. CH≡C–CH2–CH3 B. CH3–C≡C–CH3 C. CH2=CH–CH=CH2D. CH3-C≡C–CH2-CH3
55. Đ t cháy hoàn toàn 2,688 L (đktc) m t ankan và h p th h t s n ph m cháy b ng n c vôi trong d th y kh iố ộ ấ ụ ế ả ẩ ằ ướ ư ấ ố
l ng bình tăng thêm 31,92 g. Công th c phân t ankan là :ượ ứ ử
A. C2H6 B. C3H8C. C4H10 D. C5H12
56. C u t o nào d i đây phù h p v i d ki n v ch t X, bi t 1 mol X tác d ng v a đ v i 1 mol brom ho c 4 mol Hấ ạ ướ ợ ớ ữ ệ ề ấ ế ụ ừ ủ ớ ặ 2
và khi oxi hóa mãnh li t X t o ra axit ệ ạ o-phtalic o-C6H4(COOH)2.
CH CH
2
A.
CH CH
B.
CH CH
2
CH
3
C.
D.
ĐÁP ÁN đ có mã s 407ề ố
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
A C C B B A C A B B A A C D B A B A B D
21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40
C C A A C B B C C B B B C C A B D B D C
41 42 43 44 4
5
4
6
4
7
4
8
4
9
5
0
5
1
5
2
5
3
5
4
5
5
56
A A D B B D B D C A D B A B C D
H NG D N GI IƯỚ Ẫ Ả
Ph n chung dành cho t t c các thí sinhầ ấ ả
1. Ch n A.Trong c p kim lo i làm đi n c c cho m t pin đi n, thì kim lo i đóng vai trò c c âm (kim lo iọ ặ ạ ệ ự ộ ệ ạ ự ạ
đ ng tr c trong dãy đi n hóa) s b ăn mòn.ứ ướ ệ ẽ ị
2. Ch n C. Kim lo i đ y đ c Fe ra kh i mu i Fe(NOọ ạ ẩ ượ ỏ ố 3)3 là kim lo i đ ng tr c Fe trong dãy đi n hóa:ạ ứ ướ ệ
Zn + 2Fe3+ → Zn2+ + 2Fe2+ (1) Zn + Fe2+ → Zn2+ + Fe (2)
3. Ch n Cọ
Ba + 2H2O → Ba(OH)2 + H2↑ CuSO4 + Ba(OH)2 → BaSO4↓ + Cu(OH)2↓
0,2 →0,2 0,1 0,1 0,1 0,1
⇒ mk t t aế ủ = (0,1
×
233) + (0,1
×
98) = 33,1 (g)
4. Ch n B. (1) 2Họ2O + 2NaOH
n.m
dpdd
→
H2 + 2NaOH + Cl2
1 0,5
5














![Thông tư 18/2025/TT-BGDDT: [Thêm mô tả phù hợp về nội dung thông tư để tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250918/kimphuong1001/135x160/23951758170478.jpg)
![Chỉ thị 26/CT-TTg năm 2025: [Thông tin chi tiết/Hướng dẫn thi hành/Toàn văn]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250918/kimphuong1001/135x160/2851758170475.jpg)
![Nghị quyết 281/NQ-CP: Thông tin chi tiết và [thêm thông tin liên quan nếu có]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250918/kimphuong1001/135x160/13541758178551.jpg)







![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)





