Chương 7
Động học Enzyme
7.1. Ý nghĩa của việc nghiên cứu động học enzyme
Nghiên cứu động học enzyme là nghiên cứu ảnh hưởng của các
yếu tố: nồng độ cơ chất, enzyme, pH môi trường, nhiệt độ, các chất
kìm hãm… đến tốc độ phản ứng do enzyme xúc tác. Việc nghiên cứu
động học enzyme sẽ cho ta biết được các vấn đề sau đây:
- Có thể biết được cơ chế phân tử của sự tác động của enzyme.
- Cho phép ta hiểu biết được mối quan hệ về mặt lượng của quá trình
enzyme.
- Thấy được vai trò quan trọng cả về mặt lý luận lẫn thực tiễn: khi
lựa chọn các đơn vị hoạt động enzyme người ta cần phải biết những điều
kiện tốt nhất đối với hoạt động của enzyme, cũng như cần phải biết được
các yếu tố ảnh hưởng đến hoạt động của chúng.
- Là điều kiện cần thiết để thực hiện tốt các bước tinh chế enzyme,
vì người ta cần phải kiểm tra về mặt lượng bằng cách xác định có hệ thống
hoạt động của chế phẩm enzyme trong các giai đoạn tinh chế.
7.2. Động học các phản ứng enzyme
7.2.1. Ảnh hưởng của nồng độ enzyme
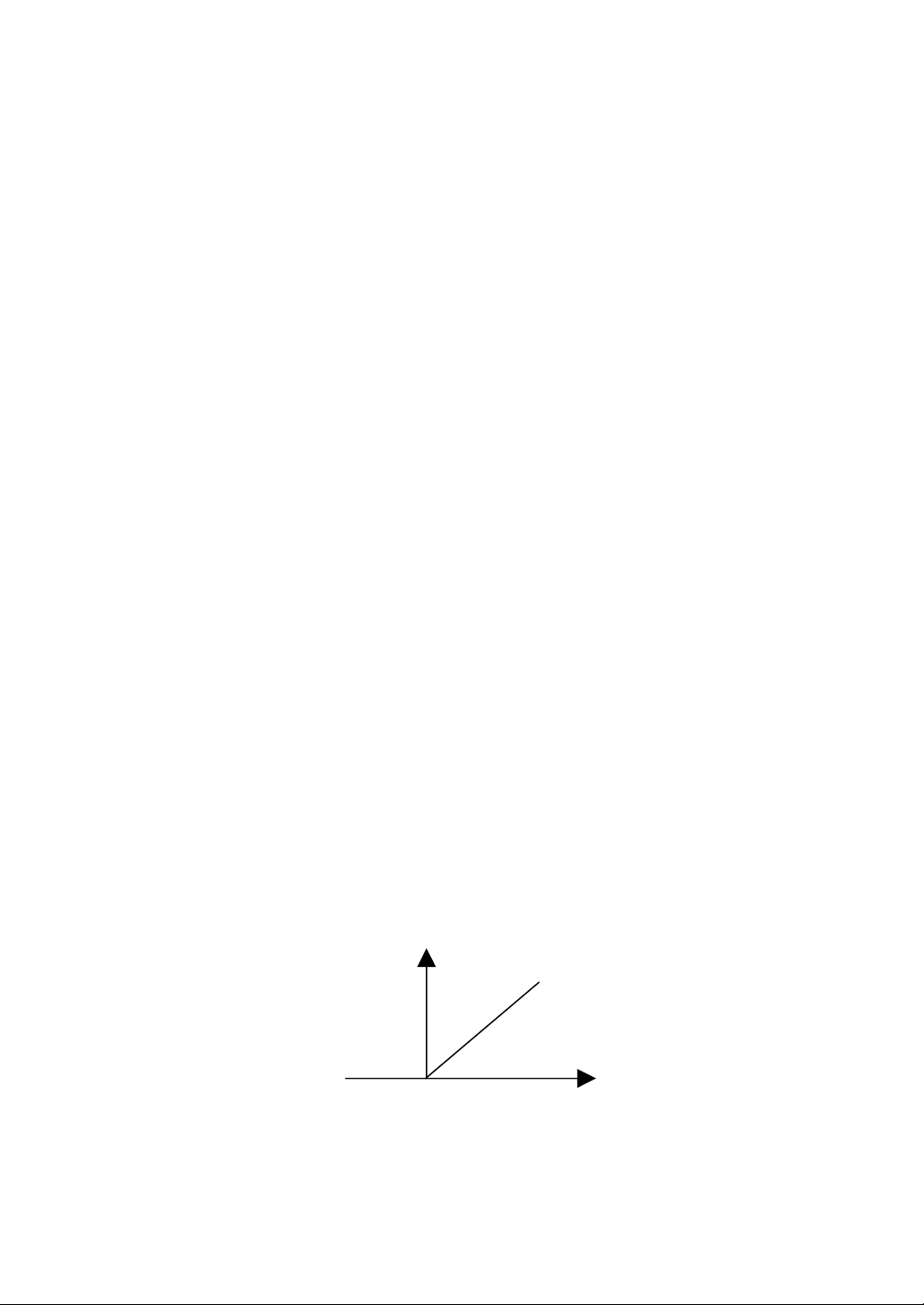
Trong điều kiện dư thừa cơ chất, nghĩa là [S] >>[E] thì tốc độ phản
ứng phụ thuộc vào [S], v= K[E] có dạng y=ax. Nhờ đó người ta đã đo [E]
bằng cách đo vận tốc phản ứng do enzyme đó xúc tác.
Có nhiều trường hợp trong môi trường có chứa chất kìm hãm hay
hoạt hóa thì vận tốc phản ứng do enzyme xúc tác không phụ thuộc tuyến
tính với [E] đó.
v
[E]
Hình 7.1. Sự phụ thuộc của vận tốc phản ứng vào [E]
74

7.2.2. Ảnh hưởng của nồng độ cơ chất [S]
Ta khảo sát trường hợp đơn giản nhất: chỉ một cơ chất
k1 k2
E + S ES E + P (1)
k-1
Gọi v1 là vận tốc của phản ứng tạo thành phức chất ES.
Gọi v-1 là vận tốc của phản ứng tạo phân ly phức chất ES tạo
thành E và S.
Gọi v2 là vận tốc của phản ứng tạo thành E và P (sản phẩm).
v1 = k1[E][S]
v-1 = k-1[ES]
v2 = k2[ES]
Khi hệ thống đạt trạng thái cân bằng ta có:
k-1[ES]+k2[ES] = k1[E][S]
(k-1+k2)[ES] = k+1[E][S] (2)
Gọi E0 là nồng độ ban đầu:
[E0]=[E]+[ES]=>[E]=[E0]-[ES] (3)
Thay trị số [E] từ (3) vào (2) ta có:
(k-1+k2)[ES] = k1([E0]-[ES]) [S]
k1 [E0] [S]
[ES] = --------------
k-1+ k2+k1[S]
Nếu đặt Km= k-1+k2/ k1
(Km: gọi là hằng số Michalis Menten)
Ta có: [ES] = [E0][S]/ Km+[S]
Mặt khác vận tốc phản ứng tạo thành sản phẩm P là:
V = k2[ES]
75
Thay [ES] bằng giá trị ở trên ta thu được:
k2[E0] [S]
v = ----------------- (4)
Km + [S]
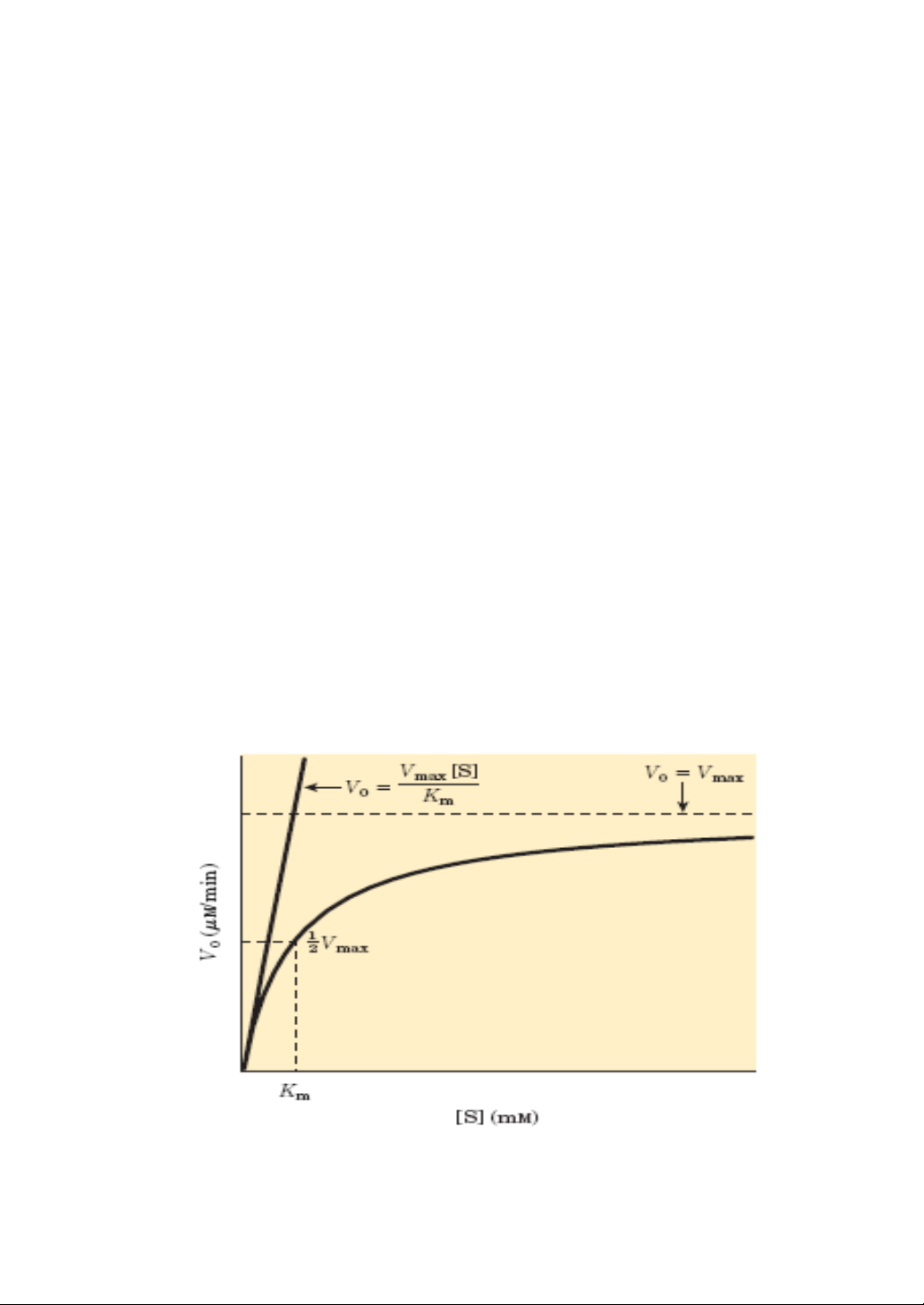
Qua đây ta thấy nồng độ enzyme càng cao thì vận tốc phản ứng
enzyme càng lớn. Vận tốc đạt cực đại khi toàn bộ enzyme liên kết với cơ
chất, nghĩa là:
Vmax= k2[E0]
Thay vào phương trình (4) ta được:
[S]
v = Vmax ------------- (5)
Km+ [S]
Phương trình (5) gọi là phương trình Michelis Menten
Km gọi là hằng số Michelis Menten đặc trưng cho mỗi enzyme.
Km đặc trưng cho ái lực của enzyme với cơ chất, Km có trị số càng nhỏ
thì ái lực của enzyme với cơ chất càng lớn, nghĩa là vận tốc của phản ứng
do enzyme xúc tác càng lớn.
Hình 7.2. Biến thiên vận tốc phản ứng theo nồng độ cơ chất
76
Khi tăng [S] thì v phản ứng tăng, tăng [S] đến một giá trị nào đó thì
v đạt đến giá trị vmax và sẽ không tăng nữa nếu ta vẫn tiếp tục tăng [S].
Khi Km = [S] thì v0 =1/2 Vmax
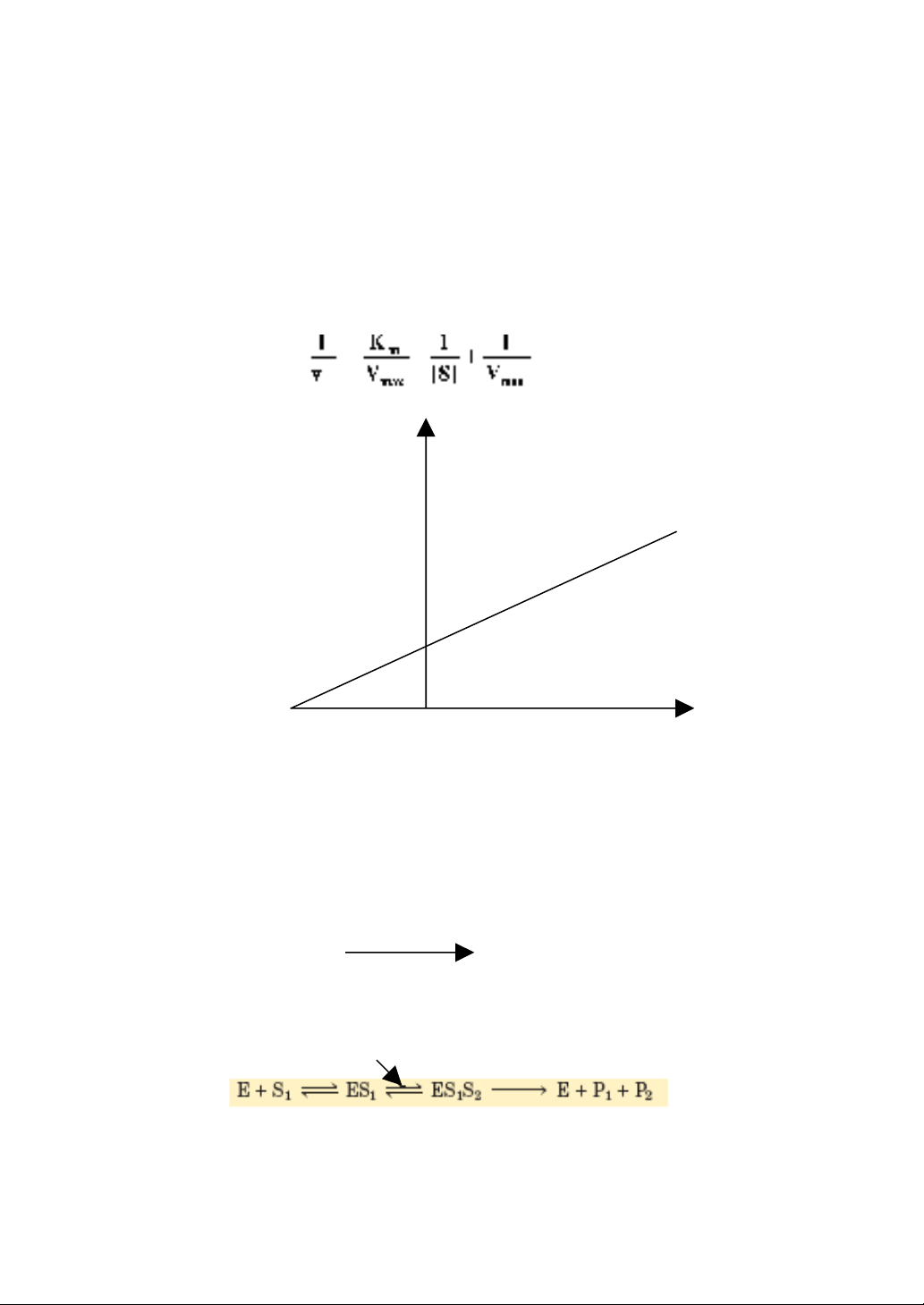
Năm 1934. Lineweaver và Burk, trên cơ sở của phương trình (5) đã
nghịch đảo để biến thành dạng đường thẳng y = ax+b, nó có ý nghĩa lớn
đối với việc nghiên cứu kìm hãm enzyme.
1/v
1/Vmax
-1/Km 1/[S]
Hình 7.3. Sự phụ thuộc của tốc độ phản ứng vào nồng độ cơ chất theo
Lineweaver-Burk
Trong nhiều phản ứng do enzyme xúc tác có 2 hay nhiều cơ chất, ví
dụ hexokinase xúc tác phản ứng:
ATP + glucose hexokinase ADP + glucose 6 phosphate
Cơ chế enzyme xúc tác cho phản ứng 2 cơ chất có thể như sau:
a/ Cơ chế tạo phức 3 thành phần
S2
77

b/ Cơ chế không tạo phức 3 thành phần
Đây là trường hợp cơ chất thứ 2 (S2) chỉ kết hợp vào enzyme ( ở
trạng thái E’) sau khi P1 được tạo thành.
Vận tốc của phản ứng trong trường hợp này có thể được phân biệt
qua hằng số Michalis-Menten đối với mỗi cơ chất. Qua nghiên cứu động
học cho thấy:
Enzyme Cơ chất Km(mM)
Phản ứng 2 cơ chất (bisubstrate) thường vận chuyển 1 nguyên tử
hay 1 nhóm chức từ cơ chất này đến cơ chất khác.
Khi cho S2 không đổi, đường biểu diễn tốc độ trong cả hai
trường hợp
78
(Não)







![Bài giảng Enzyme Công nghiệp [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2019/20190927/kuronato/135x160/2591569591154.jpg)

![Giáo trình Công nghệ Enzim Phần 2: [Mô tả/Định tính nếu cần]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20160604/tangtuy14/135x160/1762485882.jpg)
![Giáo trình Công nghệ Enzim Phần 1: [Thêm Mô Tả Chi Tiết Hấp Dẫn Hơn Về Nội Dung]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20160604/tangtuy14/135x160/2028746805.jpg)

![Giáo trình Vi sinh vật học môi trường Phần 1: [Thêm thông tin chi tiết nếu có để tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251015/khanhchi0906/135x160/45461768548101.jpg)





![Bài giảng Sinh học đại cương: Sinh thái học [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/oursky02/135x160/99371768295754.jpg)



![Đề cương ôn tập cuối kì môn Sinh học tế bào [Năm học mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260106/hoang52006/135x160/1251767755234.jpg)

![Cẩm Nang An Toàn Sinh Học Phòng Xét Nghiệm (Ấn Bản 4) [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251225/tangtuy08/135x160/61761766722917.jpg)

