
Phân tích acid nucleic – Phân tích ADN
nhiễm sắc thể
Phương pháp phân tích ở đây bao gồm việc tách ADN của nhiễm sắc thể và
cắt bằng enzym cắt hạn chế để phân biệt giữa các vi sinh vật với nhau. Một chú ý
khi tách ADN nhiễm sắc thể phải thao tác nhẹ nhàng để tránh đứt gãy do nguyên
nhân cơ học. Nói chung các mảnh cắt nên có kích thước nhỏ hơn hoặc bằng 50 kb.
Việc tách các mảnh cắt đó được thực hiện dựa vào kỹ thuật điện di trong trường
xung điện (PFGE = Pulsed Field Gel Electrophoresis ).style="text-align: justify;
margin-top: 6.0pt"> Như vậy kỹ thuật dấu vân tay không chỉ áp dụng trong
trường hợp trên tế bào mang plasmid mà kỹ thuật này còn được sử dụng với nhiễm
sắc thể cho mọi trường hợp.rường hợp.ường hợp.ường hợp.
Liên quan đến vấn đề này phải kể đến kỹ thuật BRENDA: phân tích kết quả
xử lý enzym cắt hạn chế với vi sinh vật. Ở đây cách chọn loại enzym cắt hạn chế
vô cùng quan trọng, theo cách chọn này có thể tạo ra quá nhiều mảnh cắt nên
không thể phân biệt được các băng riêng rẽ trong khi đó đối với các trường hợp
khác lại tạo ra quá ít mảnh cắt có kích thước lớn khó tách theo các kỹ thuật điện di

hiện có. Các vi sinh vật khác nhau có tỷ lệ GC khác nhau (dao động từ 25-75%)
các mảnh cắt thu được sau khi xử lý enzym cắt hạn chế rất khác nhau. Theo Nei
M. và Li W. H. (1979) thì số mảnh cắt có thể thu được tính trên lý thuyết là:
a = (g/2)r1 x {1-(g/2)}r2
Trong đó: g - tỷ lệ GC của ADN
r1 - số cặp GC
r2 - số cặp AT trong vị trí cắt của enzym giới hạn sử dụng
a - số vị trí cắt khi sử dụng enzym cắt hạn chế.
Mặt khác, người ta cũng căn cứ vào kết quả nghiên cứu các vị trí cắt của bộ
gene vi sinh vật làm cơ sở cho cách chọn enzym cắt. Thông thường cho mỗi phép
phân tích người ta ghi được số các băng cắt bởi enzym và tính toán kích thước các
mảnh tạo thành làm cơ sở cho các phép phân tích về sau. Tuy nhiên, một trong
những nguyên nhân hạn chế cho phép phân tích trên là các phương pháp tách
ADN thông thường đều dẫn đến thay đổi kích thước do đứt gãy ADN nhiễm sắc
thể, mặt khác sự có mặt của plasmid lẫn cũng tạo ra sự khác biệt giả trong kết quả
phân tích, để khắc phục nhược điểm trên người ta phải thực hiện phép phân tích
ADN nhiễm sắc thể nguyên vẹn để phát hiện các nguồn ADN tạp nhiễm lẫn vào
kết quả phân tích.

+ Kỹ thuật điện di trong trường xung điện (điện di trong trường điện thay
đổi, PFGE)
- Nguyên tắc: Trước tiên các mẫu đưa vào phân tích phải được xử lý trước
bằng loại enzym cắt hạn chế mà có rất ít điểm cắt. Kết quả phải tạo ra được các
mảnh có kích thước lớn (50 kb – 12 Mb), với kích thước này không thể điện di
theo phương pháp thông thường mà chỉ có thể tách ra bằng kỹ thuật PFGE (ật
PFGE (ật PFGE (uật PFGE (Pulsed-Field Gel Electrophoresis ). Kỹ thuật PFGE
lần đầu tiên được Schwartz va Cantor (1984) giới thiệu. Tuy nhiên sau đó đã có
nhiều tác giả mô tả lại kỹ thuật này, tuy có sai khác ít nhiều nhưng cơ sở lý thuyết
của các phương pháp này là như nhau: Mục đích của kỹ thuật này là tăng khả năng
di động của các mảnh ADN có kích thước lớn trong điện trường, do đó các thành
phần gel và đệm hầu như không thay đổi theo các phương pháp điện di thông
thường. Tuy nhiên theo phương pháp thông thường thì sự điện di liên quan đến sự
di động của các mảnh ADN có kích thước khác nhau trên gel agarose trong một
trường điện không đổi. Kết quả ở đây là phân tử lớn khó di động hơn phân tử nhỏ
qua mắt xích agarose, tạo ra sự tách biệt trong trường điện di. Trong trường hợp
PFGE lực làm thay đổi khả năng di động lại là trường điện tích thay đổi liên tục
dẫn đến các mảnh ADN có kích thước khác nhau thay đổi hướng di động. Như vậy
kết quả là các mảnh có kích thước khác nhau sẽ có khả năng di động khác nhau.
Kích thước càng lớn thì mức độ di động càng chậm. Sự di động khác nhau của
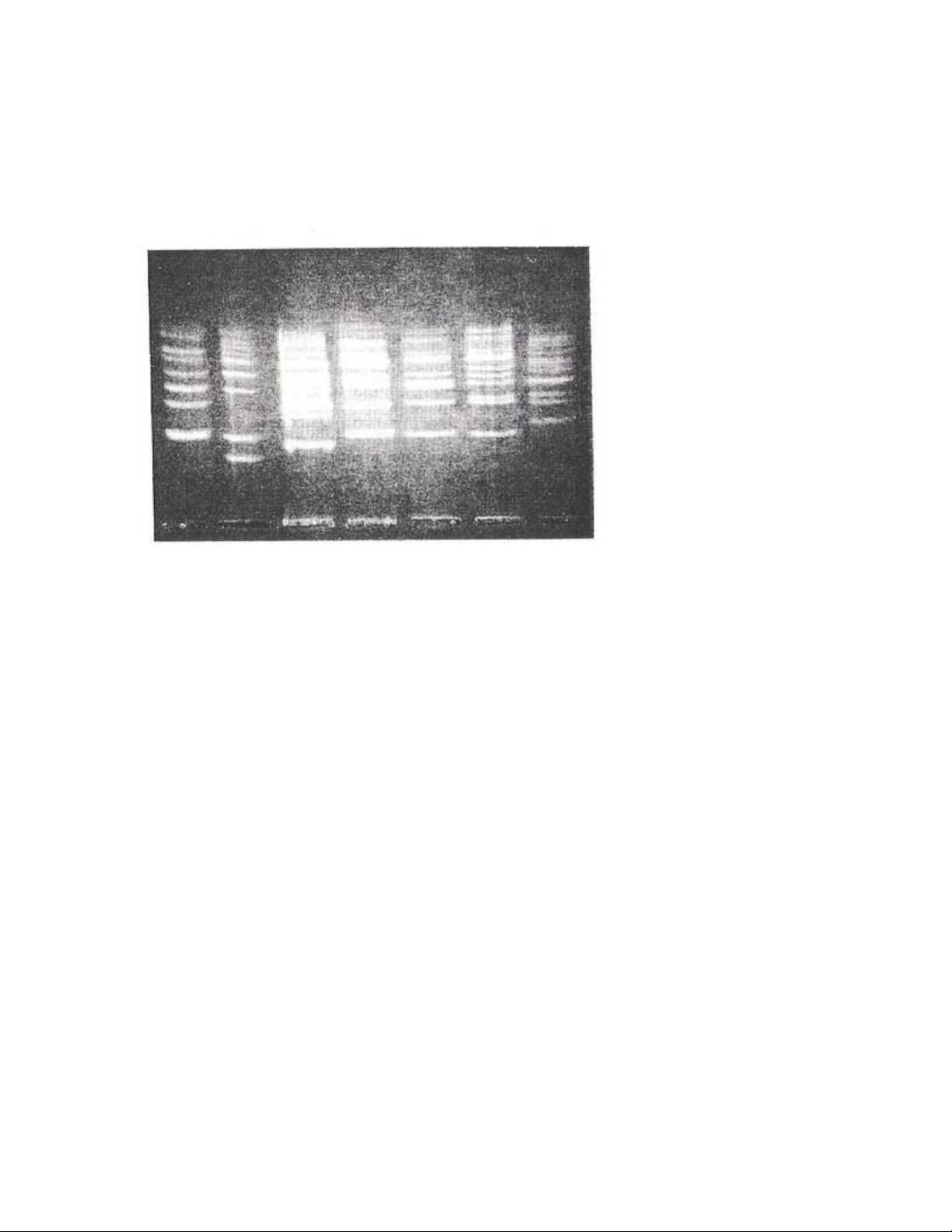
ADN chủ yếu phụ thuộc vào kích thước chứ không phải do gel agarose như ở
phương pháp điện di thông thường, hình 1.2.
Hình 1.2. Sử dụng kỹ thuật PFGE phân tích nhiễm sắc thể
sau khi xử lý với Sma I với 7 chủng Haemophilus ìnluenzae.
Tiếp theo các mô tả của Schwartz va Cantor, Smith và Codemine (1990) đã
đề cập đến sự di chuyển của các mảnh ADN khác nhau là hàm số tuyến tính với
kích thước của chúng. Trên cơ sở đó có thể điều chỉnh các xung điện và điện
trường. Tuy nhiên các nhân tố khác cũng có mối tương tác lẫn nhau và ảnh hưởng
đến khả năng di động của ADN như: nhiệt độ, điện thế, nồng độ agarose cũng như
nồng độ ion trong đệm.
- Chuẩn bị ADN cho PFGE: Chuẩn bị ADN từ nhiễm sắc thể không giống
như các phương pháp chuẩn bị ADN plasmid. Một vấn đề thường xảy ra là sự đứt

gãy ngẫu nhiên ADN dẫn đến sai khác trong kết quả phân tích. Để hạn chế điều
này người ta phải thực hiện kỹ thuật tách ADN NST khỏi tế bào mẫu agarose có
nhiệt độ nóng chảy thấp – LMT (Schwartz va Cantor – 1984 và Smith, Klco
1988). Theo phương pháp này hỗn dịch tế bào (dịch nuôi cấy hoặc dịch huyền
phù) được trộn với LMT agarose tại 37oC. Hỗn dịch đầu tiên được xử lý với
enzym và chất tẩy rửa để tách ADN NST khỏi thành, màng tế bào, RNA và
protein. Sau đó là xử lý với EDTA, bất hoạt nuclease tế bào với proteinase K và
N-lauroylsarcosine để loại các thành phần khác của tế bào. Kết quả là phần LMT
agarose có chứa ADN NST được dùng làm mẫu chạy gel 0.5-1.0% (nên làm tan ở
65oC) và đưa lên mẫu chạy gel PFGE, tài liệu của Smith (1988) mô tả chi tiết cách
chuẩn bị mẫu từ các tế bào có và không có thành tế bào: vi khuẩn, nấm men, nấm
sợi, tế bào thực vật và động vật. Nói chung với các trường hợp có thành tế bào thì
cần đến enzym phá thành tế bào. Lượng ADN NST thường dao động trong khoảng
0.5-20 µg ADN là thích hợp. Nếu quá nhiều ADN thì không thể phân tích được,
còn quá ít thì cũng không thể phát hiện được các băng ADN trong kết quả phân
tích. Mẫu ADN dùng cho kỹ thuật PFGE có thể được giữ 1 năm trong lạnh có
chứa 0.5M EDTA.
- Sau khi thu được ADN NST trong mẫu LMT agarose thì tiến hành xử lý
với enzym giới hạn loại có ít điểm cắt. Tuy nhiên mẫu đầu tiên phải được xử lý
với PMSF để bất hoạt protein K sau đó PMSF lại phải loại bỏ sau một số lần rửa
với chất tẩy rửa và EDTA. Sau đó chỉ cần phân nhỏ mẫu trong agarose được xử lý




![Tổng hợp 5-[Substituted]-1, 3, 4-thiadiazol-2-amines: Phân tích đặc tính quang phổ và đánh giá tương tác DNA](https://cdn.tailieu.vn/images/document/thumbnail/2020/20200525/tocectocec/135x160/1001590394742.jpg)





![Giáo trình Vi sinh vật học môi trường Phần 1: [Thêm thông tin chi tiết nếu có để tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251015/khanhchi0906/135x160/45461768548101.jpg)





![Bài giảng Sinh học đại cương: Sinh thái học [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/oursky02/135x160/99371768295754.jpg)



![Đề cương ôn tập cuối kì môn Sinh học tế bào [Năm học mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260106/hoang52006/135x160/1251767755234.jpg)

![Cẩm Nang An Toàn Sinh Học Phòng Xét Nghiệm (Ấn Bản 4) [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251225/tangtuy08/135x160/61761766722917.jpg)

