
Trường ĐH Nông Lâm Tp HCM
Bộ môn Công nghệ sinh học
Lớp DH06SH
CHỦ ĐỀ:
GVHD: PGS. TS. NGUYỄN NGỌC HẢI
SVTH: BÙI THỊ HỒNG GẤM
MSSV: 06126031

[Thu nhận và tinh chế enzyme]October 24, 2009
1
MỤC LỤC
YZ
I. GIỚI THIỆU CHUNG VỀ ENZYME ......................................................2
1. Định nghĩa .............................................................................................2
2. Tính chất của enzyme ............................................................................2
II. THU NHẬN CHẾ PHẨM ENZYME THÔ ............................................3
1. Một số lưu ý khi tách chiết và tinh chế enzyme .....................................3
2. Thu nhận enzyme thô .............................................................................5
III. TINH SẠCH ENZYME .........................................................................6
1. Các phương pháp tủa protein/enzyme.....................................................6
2. Sự thẩm tách ..........................................................................................8
3. Sắc ký ...................................................................................................8
4. Phương pháp dùng chất hấp phụ ............................................................14
IV. KẾT TINH PROTEIN ENZYEM..........................................................15
V. ĐÁNH GIÁ KẾT QUẢ TINH SẠCH ENZYME ...................................15
1.Xây dựng đường biểu diễn về độ hòa tan ................................................15
2. Phân tách protein/enzyme bằng điện di trên gel .....................................16
3. Phương pháp siêu ly tâm ........................................................................17
4. Kỹ thuật khối phổ ..................................................................................18
VI. XÁC ĐỊNH HOẠT ĐỘ ENZYME ........................................................18
VII. TỔNG KẾT ...........................................................................................19

[Thu nhận và tinh chế enzyme]October 24, 2009
2
ĐẶT VẤN ĐỀ
Trước thế kỷ XVII người ta đã biết sử dụng các quá trình enzyme trong đời sống song
chỉ có tính chất kinh nghiệm thực tế và thông qua hoạt động của vi sinh vật. Ðó là các quá trình
lên men rượu, muối dưa, làm tương và nước chấm...Ở thời kỳ này người ta chưa hiểu về bản
chất enzyme và các quá trình lên men. Cho đến nữa đầu thế kỷ XIX các nhà khoa học đã khái
quát được quá trình lên men là hiện tượng phổ biến trong sự sống và vai trò qua trọng của
enzyme trong chuyển hoá các chất trong quá trình lên men.
Đến nay, việc sản xuất chế phẩm enzyme các loại đã và đang phát triển mạnh mẽ trên
qui mô công nghiệp, hàng năm lượng enzyme được sản xuất trên thế giới đạt khoảng trên
300.000 tấn với giá trị trên 500 triệu USD. Thực tế đã có hàng nghìn chế phẩm enzyme bán trên
thị trường thế giới, các chế phẩm enzyme phổ biến như amylase, protease, catalase,
glucoseoxydase, cellulase, lipase…Các chế phẩm này đã được khai thác và tinh chế có mức độ
tinh khiết theo tiêu chuẩn công nghiệp và ứng dụng.
Đến nay việc nghiên cứu enzyme đã bước vào một giai đoạn mới với sự kết hợp nhiều
ngành khoa học khác nhau: hoá học protein, lý sinh phân tử, sinh học phân tử…Trong nghiên
cứu cũng như thu nhận, tinh chế enzyme, hay thiết kế định hướng những phân tử enzyme ưu
việt hơn dạng tự nhiên. Chế phẩm enzyme không chỉ được ứng dụng trong y học mà còn được
ứng dụng trong nhiều lãnh vực công nghiệp khác nhau, trong nông nghiệp, trong hóa học… Do
vậy, quá trình thu nhận và tinh sạch protein/enzyme giữ vai trò cực kỳ quan trọng và không
ngừng được cải tiến để đạt được độ tinh sạch cao nhất để phụ vụ cho con người.
TÓM TẮT
Enzyme bản chất là protein được thu nhận từ ba nguồn: động vật , thực vật, vi sinh vật.
Do đó rất đa dạng về cấu trúc, tính chất, chức năng…Nên việc thu nhận và tinh chế enzyme khá
phức tạp vì quá trình tinh chế dựa vào đặc điểm cấu tạo, tính chất của từng loại enzyme mục
tiêu, và phải trải qua nhiều công đoạn khác nhau tùy từng loại enzyme. Tuy vậy, các quá trình
tinh sạch enzyme vẫn ứng dụng các phương pháp cơ bản sau: thu dịch chiết (cơ học, lý , hoá),
tủa ( bằng muối, dung môi hữu cơ, điểm đẳng điện), thẩm tách, từng bước tinh sạch bằng sắc ký
( sắc ký lọc gel, sắc ký trao đổi ion, sắc ký lỏng cao áp), kết tinh chế phẩm, đánh giá kết quả
tinh sạch và kiểm tra hoạt tính enzyme: xây dựng đường biểu diễn về độ hoà tan, điện di (điện
di một chiều, điện di dựa vào điểm đẳng điện, điện di hai chiều, điện di mao dẫn), siêu ly tâm,
khối phổ,
I. GIỚI THIỆU CHUNG VỀ ENZYME
1. Định nghĩa
Enzyme (E) là những protein có khả năng xúc tác cho các phản ứng hoá học với mức
đặc hiệu khác nhau ở nhiệt độ tương đối thấp. E có tất cả trong tế bào sống, là các chất xúc tác
sinh học. (CNSH Enzyme và Ứng Dụng - Phạm Thị Trân Châu,Phan Tuấn Nghiã).
Trong phản ứng E xúc tác các phân tử lúc bắt đầu của quá trình được gọi là cơ chất
(substrate), E sẽ biến đổi chúng thành các phân tử khác nhau. E có hiệu suất xúc tác lớn hơn tất
cả các chất xúc tác hữu cơ và vô cơ khác. E không chỉ có thể xúc tác các phản ứng trong cơ thể
sống , mà sau khi tách ra khỏi hệ thống sống chúng vẫn giữ được hoạt tính xúc tác ở những điều
kiện nhất định.Có trên 4000 phản ứng sinh hóa được xúc tác bởi enzym [1]. E có tính đặc hiệu
cao, nghĩa là mỗi E chỉ tác dụng trên một hay một số S (cơ chất ) nhất định ở nhiệt độ và áp suất
bình thường.
[Thu nhận và tinh chế enzyme]October 24, 2009
3
2. Tính chất của enzyme
1. Enzym có bản chất là protein nên có tất cả thuộc tính lý hóa của protein. Đa số E có
dạng hình cầu và không đi qua màng bán thấm do có kích thước lớn.
2. Tan trong nước và các dung môi hữu cơ phân cực, không tan trong ete và các dung môi
không phân cực.
3. Không bền dưới tác dụng của nhiệt, nhiệt độ cao E bị biến tính. Môi trường axít hay
bazơ cũng làm E mất khả năng hoạt động.
4. Enzym có tính lưỡng tính: Tùy pH của môi trường mà tồn tại ở các dạng: cation, anion
hay trung hòa điện.
5. Enzym chia làm hai nhóm: E một cấu tử (chỉ chứa protein) như pepsin, amylase... và các
E hai cấu tử (trong phân tử còn có nhóm không phải protein).
Trong phân tử enzyme hai cấu tử có hai phần:
• Apoenzym: Phần protein, nâng cao lực xúc tác của E, quyết định tính đặc hiệu.
• Coenzym: Phần không phải protein, trực tiếp tham gia vào phản ứng E, bản chất là
những hợp chất hữu cơ phức tạp..
II. THU NHẬN CHẾ PHẨM ENZYME THÔ
1. Một số lưu ý khi tách chiết và tinh chế E
Như đã nói ở trên, E là chất xúc tác sinh học có bản chất là protein và rất không ổn định.
Trong những điều kiện bất lợi rất không bền, có thể dễ bị biến tính (denaturation) và bị mất
hoạt độ. Do đó, khi làm việc với E phải chú ý tránh làm mất hoạt tính của nó. Thông thường
phần lớn E hoạt động được ở vùng pH trung tính hoặc gần như trung tính (pH = 7+ 2). Vì
vậy các yếu tố acid mạnh, kiềm mạnh đều dễ gây biến tính E.
Nhiệt độ cao và các chất oxy hoá và chất khử, …cũng là một trong số những nguyên
nhân gây biến tính E. Tuy nhiên các E khác nhau có thể nhạy cảm với những tác nhân gây
biến tính khác nhau.
Vì thế, khi tách và tinh sạch E cần tiến hành ở nhiệt độ thấp từ 0oC đến 5oC. Đối với các
E không bền quá trình tinh sạch được tiến hành ở nhiệt độ thấp hơn từ -5oC đến
-20oC. Trong trường hợp này người ta sử dụng các hỗn hợp lạnh như nước đá với CO2 hoặc
nước đá với muối NaCl, hoặc thậm chí dùng hỗn hợp nước đá với sulfuric acid đậm đặc…
Bảng 1: Hỗn hợp làm lạnh
Thành phần hỗn hợp Tỷ lệ Nhiệt độ đạt được
Nước đá : muối 100:33 (3:1) -21,3oC
Nước đá : H2SO4 đậm đặc 100:25 (4:1) -20,0 oC
Tiến hành tinh sạch ở nhiệt độ thấp vừa hạn chế biến tính E cũng như tác dụng phân giải
của các E proteolytic có mặt trong dịch chiết. Đối với nhiều E có thể bổ sung chất ức chế
của E proteolytic vào dịch chiết để hạn chế sự thủy phân đối với E quan tâm. Các E
[Thu nhận và tinh chế enzyme]October 24, 2009
4
proteolytic được phân thành 4 lớp: protease serin, protease cystein, protease acid, protease
chứa kim loại.
Trên cơ sở 4 lớp của protease này, người ta cũng chia chất ức chế của E này thành 4 lớp
tương ứng. chất ức chế hai E protease serine và protease cystein được sử dụng nhiều do sự
phổ biến của hai E này. Đối với một số E nhạy cảm với các phân cắt proteolytic, thì cả 4
loại chất ức chế đều được sử dụng.
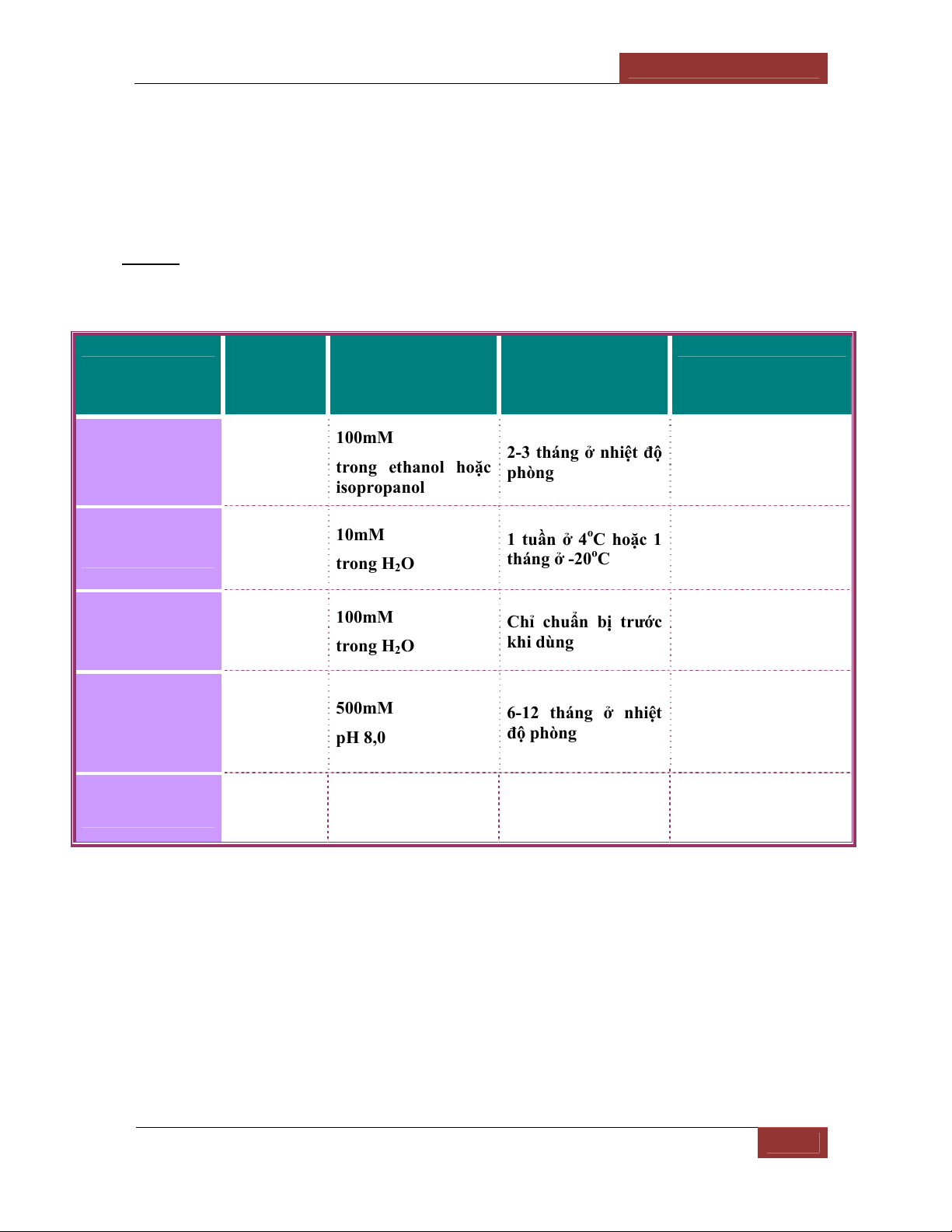
Bảng 2: Một số chất ức chế E proteolytic thường dùng trong tách chiết, tinh sạch
protein/E
Chất ức chế
Nồng độ và
thời gian
hiệu quả
Dung môi pha dung
dịch gốc và nồng độ
chất ức chế
Điều kiện và thời
gian bảo quản ở
dạng dung dịch gốc
E proteolytic bị ức chế
Phenyle methyl
sulphonyl
fluoride (PMSF)
0,1-1mM
vài giờ
100mM
trong ethanol hoặc
isopropanol
2-3 tháng ở nhiệt độ
phòng Protease serine
Leupeptin 10-100μM 10mM
trong H2O
1 tuần ở 4oC hoặc 1
tháng ở -20oC
Protease kiểu trypsin
và một số kiểu
protease cystein
Iodoacetic acid
hay iodoacetate
(IAA)
10-100μM
vài giờ
100mM
trong H2O
Chỉ chuẩn bị trước
khi dùng Protease cystein
Ethylene diamine
tetra acetic acid
(EDTA)
1-2mM,
lâu dài
500mM
pH 8,0
6-12 tháng ở nhiệt
độ phòng
Protease chứa kim
loại (trừ loại chứa
Ca2+ thì phải dùng
EGTA)
Pepstain A 1μM
vài giờ
1mM
trong tanol 3-4 tháng ở -20oC Một số protease acid
Bổ sung các yếu tố làm bền (như CaCl2 hay MgCl2 với nồng độ 2-5mM, glycerol 10-
20%...), chất chống oxy hoá (β-mercaptoethanol hay dithiothreitol 1-5mM…).
Xây dựng quy trình đơn giản cũng là cách để bảo toàn hoạt tính E. Đối với một số E bền
nhiệt thì có thể dùng bước xử lý nhiệt (70-80oC, trong vòng 15-30 phút) và xử lý acid (pH
3-4) đối với các E bền acid nhằm hạn chế tác dụng phân cắt của proteolytic, vừa loại bỏ một
số protein không mong muốn.
Tránh tạo bọt khí vì nhiều E sẽ biến tính ở mặt phân cách hai pha nước và khí. Để tránh
bọt khí. Chỉ sử dụng các gụng cụ inox để cắt xay nguyên liệu để tránh tác dụng của kim loại
nặng làm mất hoạt tính E.




![Tiểu luận công nghệ bảo quản và chế biến khoai mỳ [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2013/20131013/mylanbach/135x160/6611381635829.jpg)











![Bệnh Leptospirosis: Khóa luận tốt nghiệp [Nghiên cứu mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250827/fansubet/135x160/63991756280412.jpg)









