
Department of Analytical Chemistry
School of Chemical Engineering – Hanoi University of Science and Technology (HUST)
Chương 3.
Phản ứng tạo phức và chuẩn độ theo
phản ứng tạo phức
Trần Thị Thúy
HUST SCE
Outline
3.1 Khái niệm về phức chất
3.2 Cách tạo phức và độ bền của phức
3.3 EDTA
3.4 Chuẩn độ EDTA
3.5 Chất trợ tạo phức
3.6 Các chất chỉ thị ion kim loại
3.7 Các kỹ thuật chuẩn độ EDTA
2 8/13/2020
HUST SCE
3
3.1 Khái niệm về phức chất
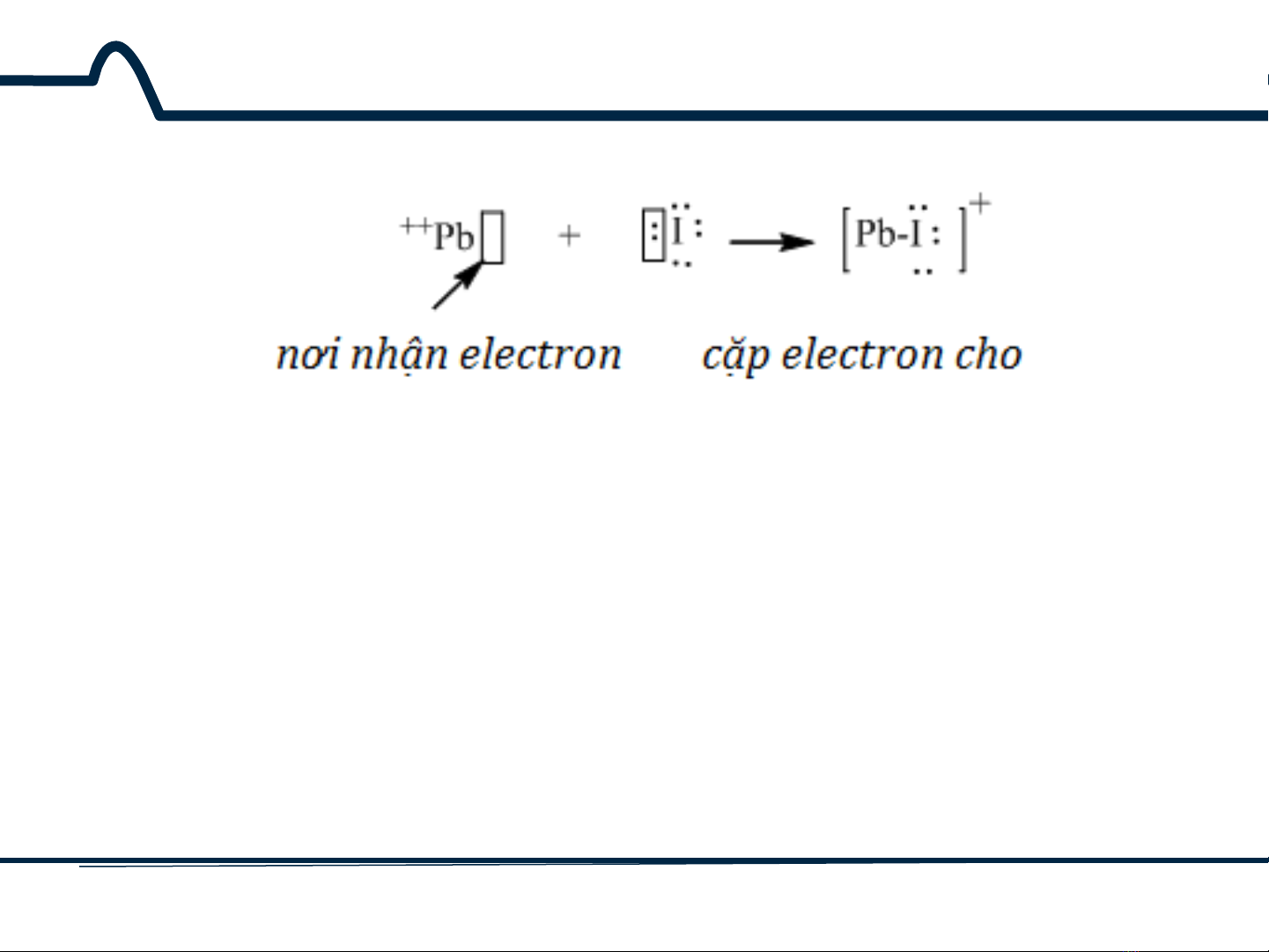
Hoạt động của Pb2+ như một axit Lewis và hoạt động của I–
như một bazơ Lewis trong trường hợp tạo phức này. Axit
Lewis nhận một đôi điện tử từ một bazơ Lewis khi tạo liên
kết.
I– (có khả năng cho đôi điện tử vào ô trống của ion kim loại)
được gọi là phối tử của Pb2+.

HUST SCE
4
3.1 Khái niệm về phức chất
Ag+ + :C–≡N: ⇋ [:N≡C-Ag-C≡N:]–
Axit Lewis bazơ Lewis ion phức
(cặp electron nhận) (cặp electron cho)
Phối tử
đơn càng
(CN–) liên kết với một ion kim loại chỉ với
một nguyên tử
(nguyên tử cacbon)
.
Sản phẩm phản ứng giữa một axit Lewis và một bazơ Lewis được gọi là
sản phẩm phức, hay sản phẩm cộng. Liên kết giữa một axit Lewis và
một bazơ Lewis được gọi là liên kết cho nhận hay liên kết phối trí.
HUST SCE
5
3.1 Khái niệm về phức chất
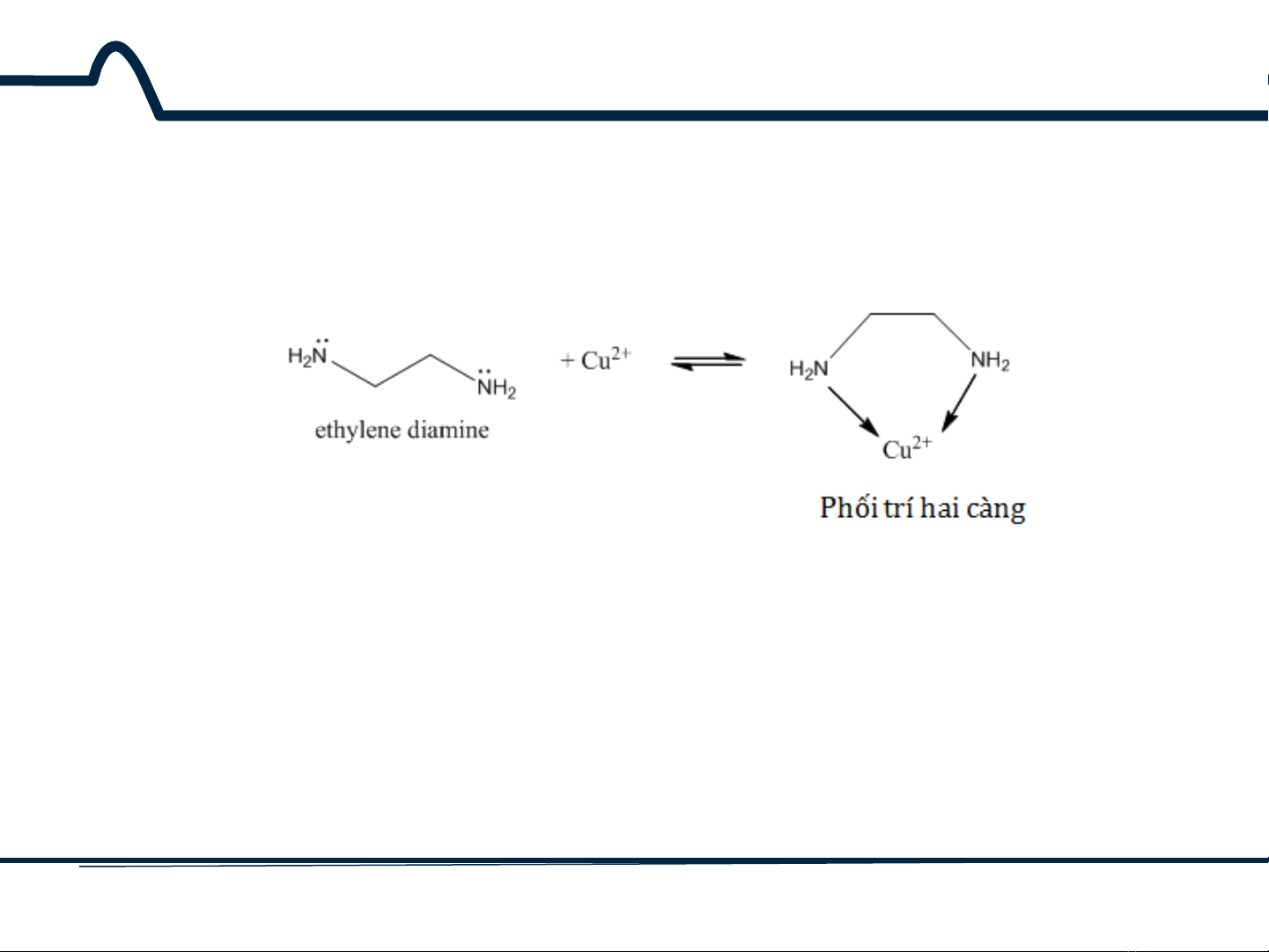
Phối tử mà tấn công ion kim loại nhiều hơn một nguyên tử
được gọi là phối tử đa càng.
Ví dụ:
Phối trí hai càng còn gọi là chelate (
chelate xuất phát từ
tiếng Hy Lạp là chȅlé nghĩa là càng cua)
.






![Bài giảng Hóa phân tích TS. Lê Thị Hải Yến: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230607/phuong3129/135x160/2361686125460.jpg)






![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)












