
CHƯƠNG 2
CÁC KHÁI NIỆM VÀ
ĐỊNH LUẬT CƠ BẢN
1

NỘI DUNG
1.
DUNG DỊCH VÀ
NỒNG ĐỘ
DUNG DỊCH
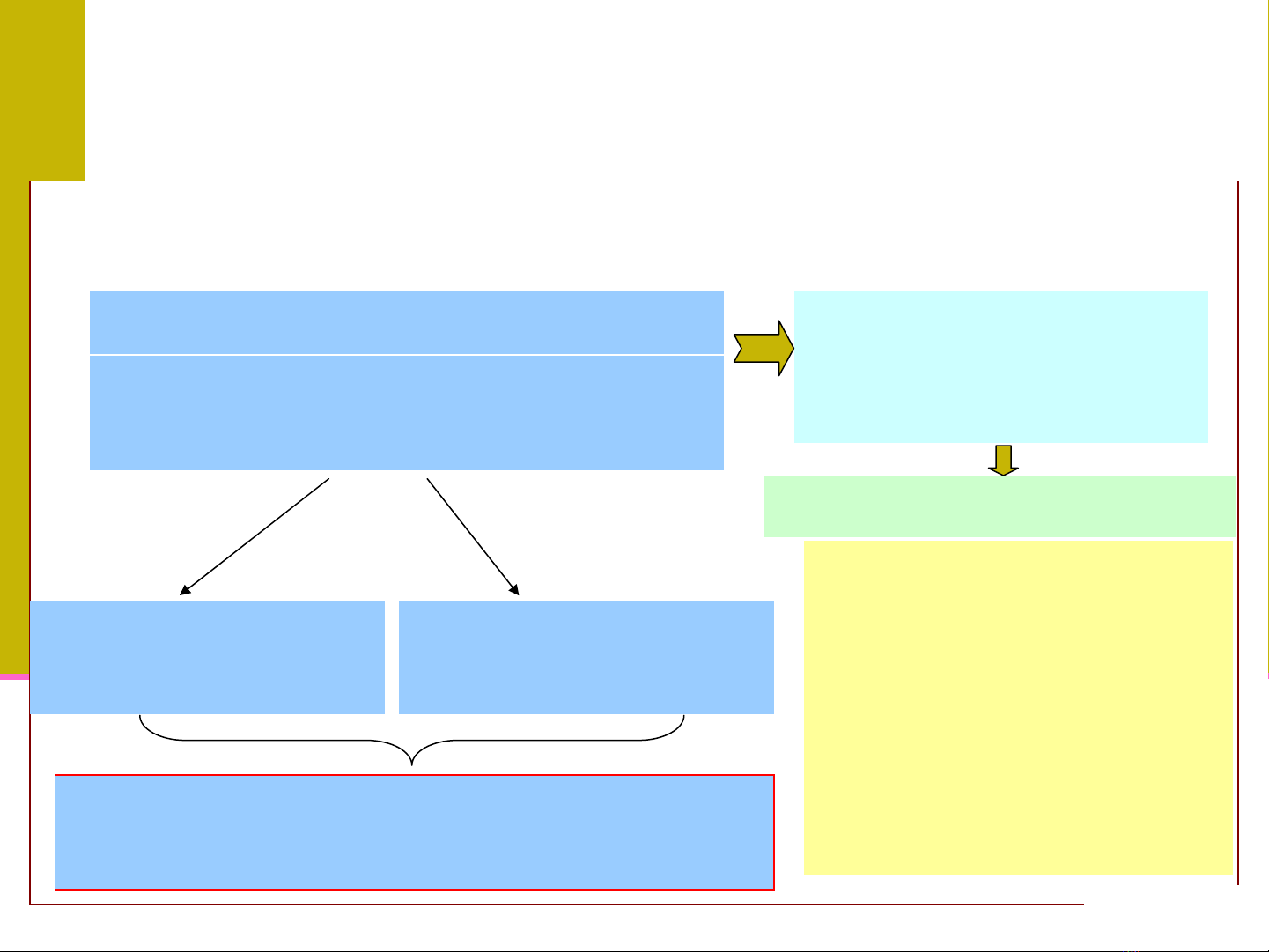
¾Khái niệm dung dịch
¾Các loại nồng độ dung dịch và cách biểu thị
¾Các cách quy đổi giữa các dạng nồng độ
2.
CÂN BẰNG HOÁ
HỌC – ĐL TÁC DỤNG KHỐI
LƯỢNG
3.
ĐỊNH LUẬT TÁC DỤNG ĐƯƠNG LƯỢNG
2
DUNG DỊCH –
NỒNG ĐỘ
DD
1.
KHÁI NIỆM DUNG DỊCH
Dung dịch (dd) là
hệ đồng thể
do sự
phân tán của các phân
tử
hay ion vào nhau
1.
R/L
(dd NaCl)
2.
L/L (Rượu/H2
O)
3.
K/L (DD HCl)
4.
R/K (bụi/ko khí)
5.
R/R (hợp kim)
6.
L/K (sương mù)
chất phân tán
(chất tan)
Môi trường phân
tán (d_môi)
Tùy trạng thái tập
hợp của chất phân
tán và
MT phân tán
Thành phần thay đổi trong một
giới hạn rộng
các dạng dd khác nhau
3
DUNG DỊCH –
NỒNG ĐỘ
DD
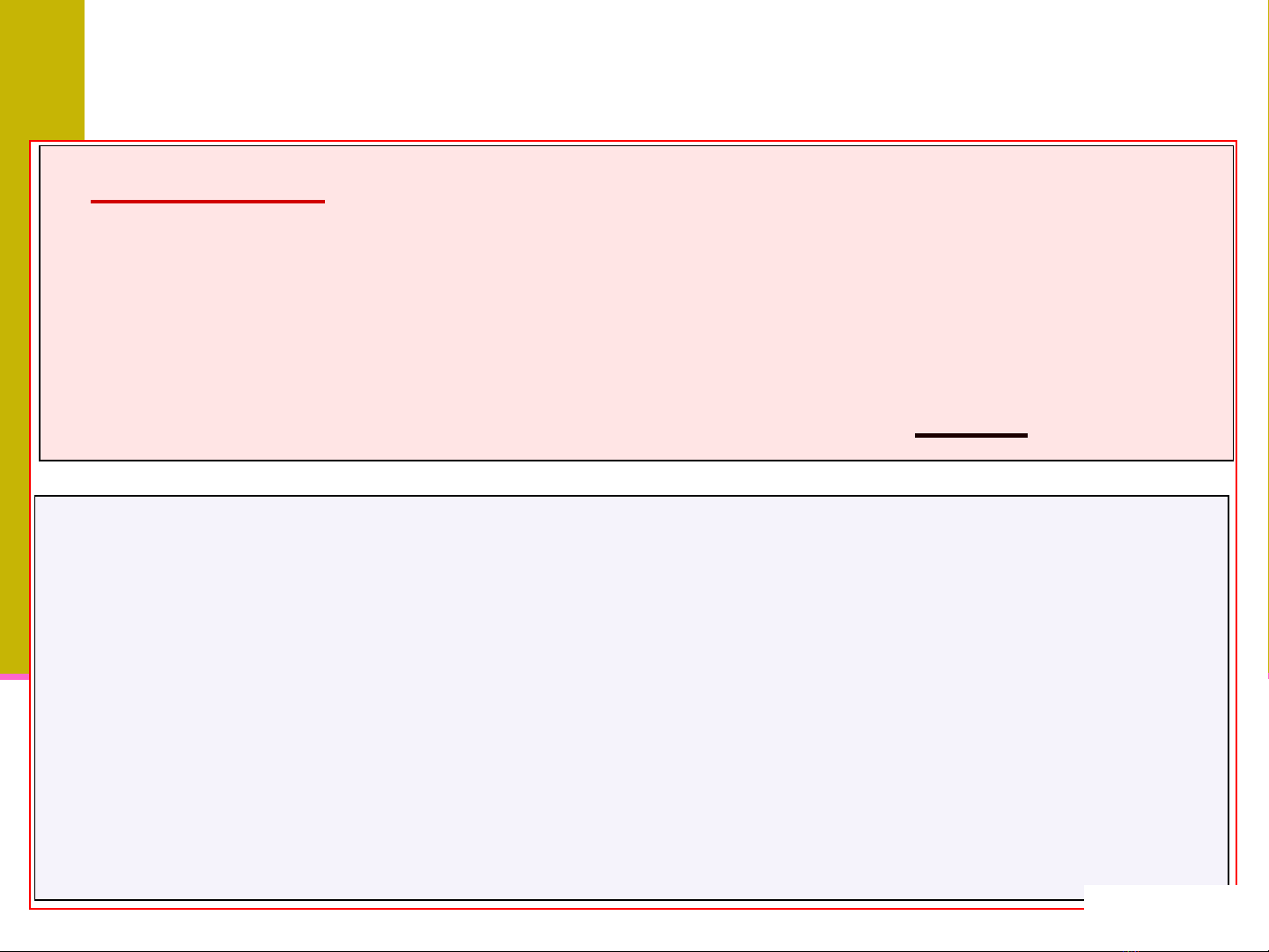
¾Nồng độ dd:lượng chất tan trong lượng dmôi xác định.
¾Dung dịch loãng ⇒chất tan ít
¾Dung dịch đậm đặc ⇒chất tan chiếm tỷlệlớn.
¾Dung dịch bão hoà ⇒chứa chất tan tối đa.
•m (g): Khối lượng chất tan •
q (g) : Khối lượng dung môi
•Vx
(ml): Thể
tích chất tan
•V (ml) : Thể
tích dd cho hoà
tan m (g) vào Vx
(ml) dung môi
•d (g/ml): Khối lượng riêng của dd thu được.
Các đại lượng liên quan đến chất tan và
dung môi
trong dung dịch
4
DUNG DỊCH –
NỒNG ĐỘ
DD
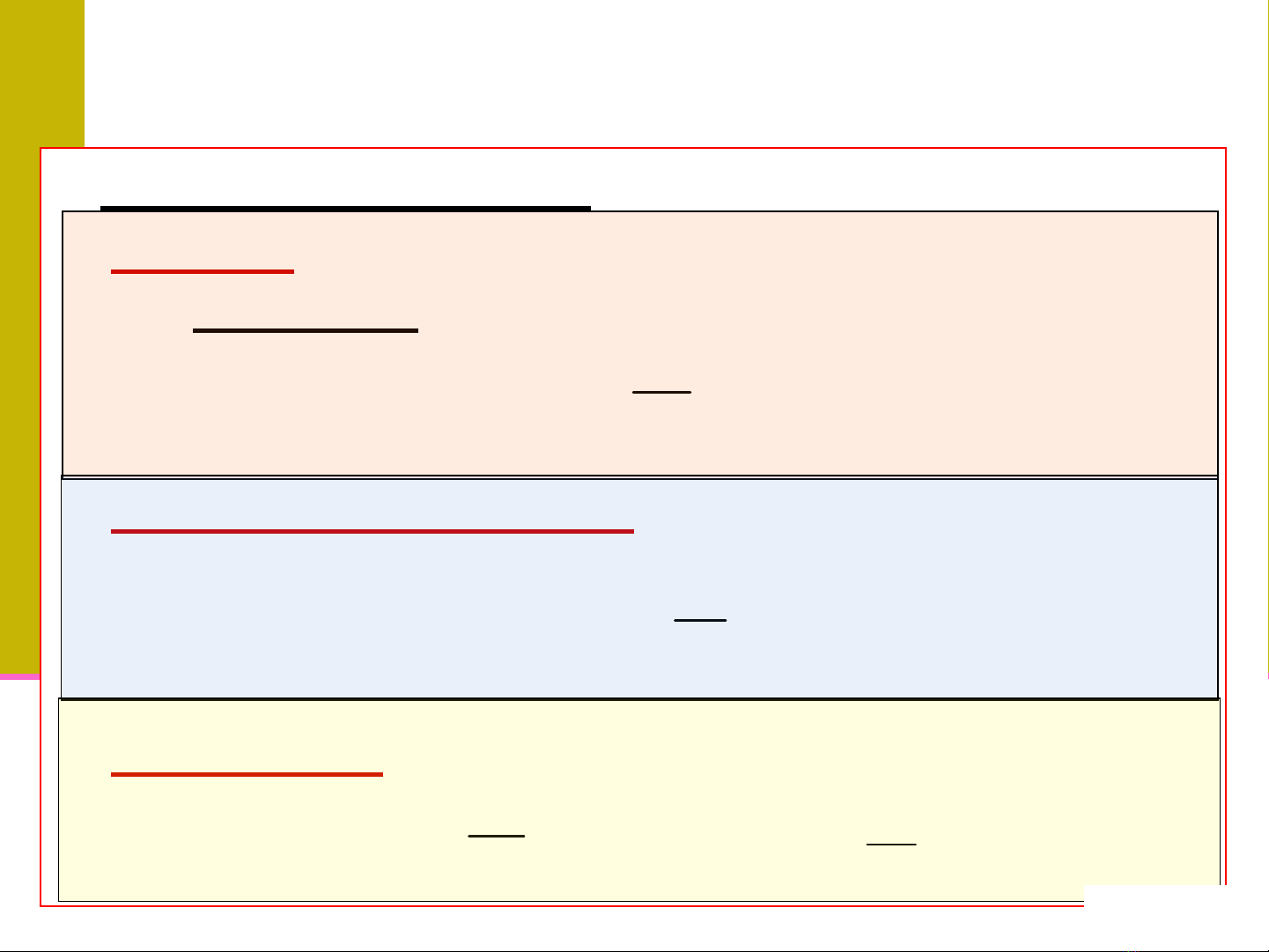
CÁC LOẠI NỒNG ĐỘ DD
¾Độ tan S: lượng chất tan trong 100 g dung môi để tạo
nên dd bão hoà (ở điều kiện tovà P xác định).
¾Nồng độ khối lượng (g/l): Sốg chất tan có trong 1 lít
dd
¾Độ chuẩn (T): Sốg (hay mg) chất tan trong 1 ml DD
100.
q
m
S=
1000.
/V
m
Clg =
V
m
Tmlg =
/1000.
/V
m
Tmlmg =
5






![Bài giảng Hóa phân tích TS. Lê Thị Hải Yến: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230607/phuong3129/135x160/2361686125460.jpg)





![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













