Vũ Hồng Sơn-ĐHBK HN 27
6. Định lượng gluxit bằng phương pháp sắc ký-điện di
– Phương pháp sắc ký-điện di trên giấy
– Phương pháp sắc ký cột
–Phương pháp sắc ký khí (GC)
–Phương pháp sắc ký lỏng hiệu năng cao (HPLC)
Vũ Hồng Sơn-ĐHBK HN 28
CHƯƠNG 4. LIPIT
Mục đích
1. Định lượng lipit
1. Trích ly trực tiếp
2. Trích ly sau khi xử lý hóa học
2. Nghiên cứu thành phần cơ bản của lipit
1. Nghiên cứu cấu trúc
–Nghiên cứu triglyxerit bằng HPLC
–Nghiên cứu axit béo tại vị trí 2
2. Phân tích axit béo bằng GC
3. Chất không xà phòng hóa
PhD. Vũ Hồng Sơn-ĐHBK 14

Vũ Hồng Sơn-ĐHBK HN 29
3. Nghiên cứu chất lượng lipit
1. Đo mức độ thủy phân lipit
– Trị số axit
4.3.2. Đo mức độ oxy hóa
– Trị số peroxyt (PV)
– Phản ứng Kreiss
– Trị số p-anisidin (p-AnV)
– Phản ứng TBA
– Phổ hấp thụ tử ngoại
–Xác định axit oxy hóa
– Phương pháp Rancimat
Vũ Hồng Sơn-ĐHBK HN 30
CHƯƠNG 5. PROTEIN
1. Định lượng protein bằng Ntổng số
Hệ số chuyển đổi từ N tổng đạm tổng
–Protein động vật: 6,25
–Protein thực vật: 5,7
5.1.1. Xác định N amoniac
•Vô cơ hóa
Chuyển N hữu cơ thành NH3(Vô cơ hóa bằng axit H2SO4)
•Chuẩn độ NH3
– Phương pháp Kjeldahl
Cất NH3bằng bộ cất đạm Kjeldahl
(NH4)2SO4+ NaOH NH3+ H2O + Na2SO4
PhD. Vũ Hồng Sơn-ĐHBK 15
Vũ Hồng Sơn-ĐHBK HN 31
Thu NH3: 2phương pháp
•Dùng H3BO3 với thuốc thử Taxiro
NH4OH + H3BO3(NH4)2B4O7+ H2O (màu xanh)
Chuẩn tetraborat amon
(NH4)2B4O7+ H2SO4(NH4)2SO4+ H3BO3(màu tím)
•Dùng H2SO4
NH4OH + H2SO4(NH4)2SO4+ H2O
Chuẩn H2SO4dưbằng NaOH
Vũ Hồng Sơn-ĐHBK HN 2
3
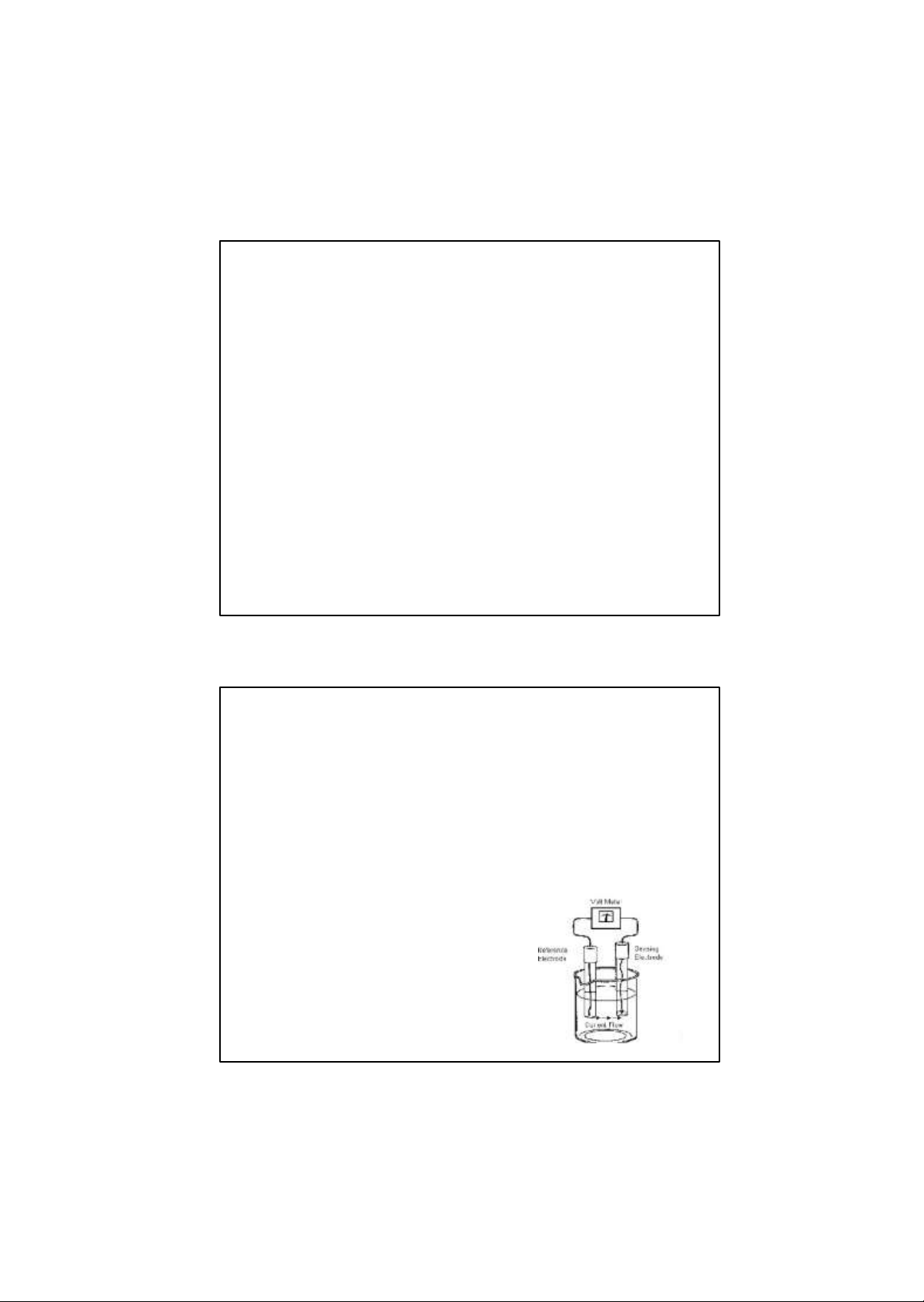
– Phương pháp chuẩn độ điện thế
Dùng điện cực amoniac: chứa NH4Cl được ngăn cách với bên ngoài
bằng màng kỵ H2Ocó khả năng cho khí đi qua.
Tại điện cực thiết lập cân bằng:
NH3+ H2O↔NH4++OH-
E = Eo+ 0,059lg[NH3]
Định luật trên đúng khi [NH4+] trong khoảng 10-6M-1M. Để toàn bộ
NH4+NH3cần tạo pH >11
PhD. Vũ Hồng Sơn-ĐHBK 16

Vũ Hồng Sơn-ĐHBK HN 33
– Phươngpháp so màu
•Dùng thuốc thử NESSLER
Thuốc thử Nessler (HgI + KI) + NH4+phức màu da cam, hấp thụ ở bước
sóng 389nm
• Phươngpháp Berthelot
NH4++ fenat Na + hypoclorit phức màu xanh, hấp thụ cức đại ở 630nm
• Phản ứng với xalixilat
NH4++HOC6H4COOH (với sự có mặt của clo) cho độ nhạy gấp 200 lần
phương pháp Berthelot khi có mặt nitroxianat. Phương pháp này được sử
dụng rộng rãi do dễ dàng tự động hóa.
Vũ Hồng Sơn-ĐHBK HN
Assay absorption mechanism detection limit
UV absorption 280 nm
Tyrosine and
tryptophan
absorption
0.1-100 ug/ml
low cost
advantages disadvantages
incompatible
small sample with detergents
volume, rapid, and denaturating
agents, high
variability
Bicinchoninic
acid 562 nm 20-2000 ug/ml
compatible with low or no
detergents and compatibility
denaturating with reducing
agents, low agents
variability
Bradford or
Coomassie
brilliant blue
470 nm 20-2000 ug/ml
compatible with
rapid
reducing agents, incompatible
with detergents
Lowry 750 nm
copper reduction
(Cu2+ to Cu1+),
BCA reaction
with Cu1+
complex
formation
between
Coomassie
brilliant blue dye
and proteins
copper reduction
by proteins,
Folin-Ciocalteu
reduction by the
copper-protein
complex
10-1000 ug/ml high sensitivity
and precision
incompatible
with detergents
and reducing
agents, long
procedure
34
PhD. Vũ Hồng Sơn-ĐHBK 17

Vũ Hồng Sơn-ĐHBK HN 35
5.1.2. Phương pháp nhiệt phân (Dumas)
–Nguyên tắc:dựa trên sự tro hóa mẫu vật với ự có mặt của CuO. Cacbon
và hydro bị oxy hóa tạo CO2và H2O. Nito tạo thành N2và được định
lượng bằng detector dẫn nhiệt.
Phương pháp này hiện nay đang được sử dụng rộng rãi (TCVN
7598:2007) do ưu điểm thời gian phân tích nhanh (3-5 min), ít gây ô
nhiễm môi trường và cho kết quả rất tốt khi so sánh với phương pháp
Kjeldahl.
Vũ Hồng Sơn-ĐHBK HN 36
PhD. Vũ Hồng Sơn-ĐHBK 18











![Đề cương ôn thi Phụ gia thực phẩm [năm hiện tại]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251120/kimphuong1001/135x160/63671763608893.jpg)









![Đề cương ôn thi giữa kì môn Đánh giá cảm quan trong kiểm soát chất lượng [năm]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251003/maihonghieu2004@gmail.com/135x160/69751759740815.jpg)




