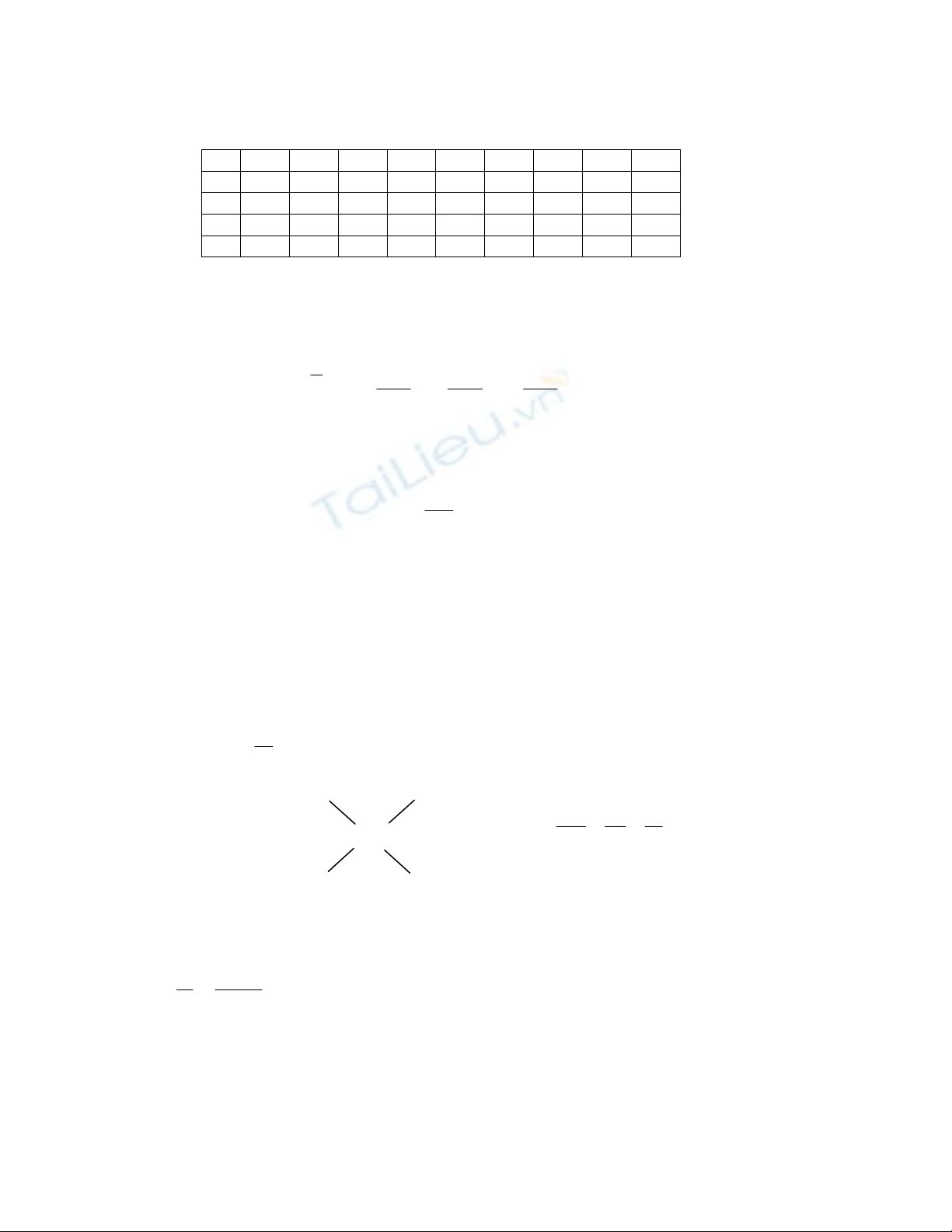
§¸p ¸n ®Ò 10
1C
6D 11D
16A
21B
26C
31A
36D
41D
46C
2D
7A 12B
17D
22A
27B
32B
37A
42D
47A
3B
8D 13B
18C
23C
28A
33C
38D
43C
48D
4B
9B 14B
19A
24C
29C
34B
39C
44D
49B
5C
10D
15D
20B
25C
30B
35D
40B
45C
50D
H−íng dÉn gi¶i mét sè c©u hái
10. Gi¶i
Gäi sè khèi cña ®ång vÞ ch−a biÕt cña nguyªn tè agon lµ A
3
Ta cã
= + + =
Ar 3
0,34 0, 06 99, 6
A 36 38 A 39, 98
100 100 100
⇒ A
3
= 40
12. §¸p ¸n A.
V×: m
hh
= m
hhsau p−
+ m
O(trong oxit)
= 215 +
15
.16
100
= 217,4 (gam).
13. §¸p ¸n B.
Gi¶i:
Theo PT: 1 mol
2
3
CO
−
→
2mol Cl
-
+ 1mol CO
2
→
m
muèi t¨ng
= 71 - 60 = 11 g
Theo gt: x mol 0,03mol 11.0,03 =0,33g
10 0,33 10,33
muoi
m= + =
∑
(gam).
16. §¸p ¸n A
Gi¶i:
hh
M
= 1,5.16 = 24
2
H
V
2 4
24 11
2
22
4
2
==→
CO
H
V
V
CO
V 28 22
19. §¸p ¸n A
H−íng dÉn: ¸p dông ph−¬ng ph¸p b¶o toµn electron ta cã:
n
e
=
It
F
=
1,34.2
26,8
= 0,1 (mol) electron
Qu¸ tr×nh katot Qu¸ tr×nh anot
Cu
2+
+ 2e → Cu 2Cl
-
- 2e → Cl
2
0,05 0,1 0,05 0.06 0,06 0,03 (mol)

Khèi l−îng ®ång tho¸t ra lµ H
2
O - 2e →
1
2
O
2
+ 2H
+
0,05 x 64 = 3,2 (gam). 0,1 - 0,06 = 0,04 0,01
ThÓ tÝch khÝ tho¸t ra ë anot = (0,03 + 0,01) x 22,4 = 0,896 (lit).
20. §¸p ¸n B.
Gi¶i: CO + O
(trongoxit)
→ CO
2
⇒
m
KL
= m
hh
- m
O(trong oxit)
n
O(trong oxit)
= n
COp−
=
15,68
22, 4
= 0,7 (mol)
⇒
m
KL
= 40 - 16.0,7 = 28,8 (gam).
23. §¸p ¸n C
Gi¶i
Theo ph−¬ng ph¸p b¶o toµn electron, tæng sè mol electron thu b»ng tæng sè mol
electron nh−êng. Tæng e thu = (0,015x4x2) + (0,01x3)=0,15(mol).
Tæng sè e nh−êng = 0,15mol ⇒ n
Fe
= 0,15:3 = 0,05 (mol)
Khèi l−îng Fe = 0,05x56 = 2,8g
24. §¸p ¸n C.
V×: n
O(trong oxit)
= 2.
2
CO
n
= 0,1.2 = 0,2 (mol)
m
hhban ®Çu
= m
hhKL
+ m
O(trong oxit)
= 2 + 16.0,2 = 5,2 (gam).
25. §¸p ¸n C
2
2, 24
22, 4
CO
n
==0,1mol;
2
( )
Ca OH
n
=0,075mol Tû lÖ 2 >
2 2
( )
0,1
:
0, 075
CO Ca OH
n n
=> 1
S¶n phÈm lµ hçn hîp hai muèi CaCO
3
vµ Ca(HCO
3
)
2
26. §¸p ¸n C
CO vµ H
2
kh«ng khö ®−îc Al
2
O
3.
34. §¸p ¸n B
Gi¶i thÝch : phenol vµ anilin lµm mÊt mµu dung dÞch brom v× mËt ®é electron cao ë c¸c
vÞ trÝ octo vµ para. So víi phenol anisol cã mËt ®é e lín h¬n ë c¸c vÞ trÝ octo vµ para v×
nhãm CH
3
®Èy electron.
35. §¸p ¸n D
Anbumin + dd CuSO
4
t¹o dung dÞch mµu xanh tÝm.
NaOH + dd CuSO
4
t¹o kÕt tña mµu xanh nh¹t.
Glixerol + dd CuSO
4
t¹o dung dÞch mµu xanh thÉm.
CH
3
COOH + dd CuSO
4
t¹o dung dÞch mµu xanh.
36. §¸p ¸n D.
Gi¶i
PTTQ cña este: C
n
H
2n-2
O
2
+
3 1
2
n
+
O
2
→
nCO
2
+ (n-1) H
2
O

n
axit
=
OHCO
nn
22
−
=0,25 - 0,2 = 0,05 (mol).
37. §¸p ¸n A.
V×: 2
R
COOH + Na
2
CO
3
→
2
R
COONa + CO
2
+ H
2
O
0,2 0,2 0,1
⇒
m = 14,8 + 0,2 . (23 - 1) = 19,2 (gam).
39. §¸p ¸nC. Theo §L b¶o toµn khèi l−îng:
12
5
6,0
25,0
6,03,0.2.2
)(3,0
100
25
.22.
4,22
96,8
.2
)()(
)()()()(
2
22222
==⇒===
=−=⇒+=+=
H
C
OtrongHHcacbontronghidroH
OHOOHCOOHOCOOpuO
n
n
nn
molnnnnnn
⇒
CTPT: C
5
H
12
40. §¸p ¸n B.
n
kÕt tña
=
100
10 = 0,1 (mol)
CH
4
+ O
2
→
CO
2
+ 2H
2
O (1)
CO
2
+ Ca(OH)
2
→
CaCO
3
(2)
0,1 0,1 0,1
4
CH
m
=
0,1x16= 1,6gam



![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)










![Phiếu bài tập cuối tuần Tiếng Việt 1 tuần 2 đề 2: [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250728/thanhha01/135x160/42951755577464.jpg)

