
anion nhãm I: Cl-, Br-, I-, SCN-, S2O32-
Môc tiªu
1. ViÕt ®−îc ph¶n øng cña thuèc thö nhãm víi c¸c anion nhãm I
2. Gi¶i thÝch ®−îc c¸c b−íc ph©n tÝch theo s¬ ®å 6 ®Ó t¸ch riªng vµ t×m tõng anion
1. TÝnh chÊt chung
−
C¸c anion nhãm I t¹o kÕt tña víi Ag+ trong m«i tr−êng acid HNO3
lo·ng. Muèi b¹c cña c¸c anion nhãm nµy kh«ng tan trong acid HNO3.
V× thÕ AgNO3 + HNO3 ®−îc gäi lµ thuèc thö nhãm ®Ó t¸ch riªng anion
nhãm I ra khái hçn hîp ph©n tÝch. Sau ®ã dùa vµo c¸c ph¶n øng ®Æc
tr−ng cña tõng anion ®Ó t¸ch vµ ph¸t hiÖn chóng.
−
§Ó lo¹i c¸c cation g©y trë ng¹i khi x¸c ®Þnh c¸c anion, cÇn chuyÓn
dung dÞch ph©n tÝch thµnh n−íc soda (xem môc 4 Bµi 2). Ch¼ng h¹n,
trong n−íc soda th× Hg2+ ®−îc lo¹i bá, nhê ®ã c¸c anion Cl-, I- ®−îc gi¶i
phãng khái HgCl2, HgI+, HgI3- lµ nh÷ng hîp chÊt tan nhiÒu nh−ng
®iÖn ly rÊt kÐm
2. C¸c ph¶n øng ph©n tÝch ®Æc tr−ng cña anion nhãm I
2.1. Ph¶n øng cña Cl-
−
Víi Ag+:
Cl- + AgNO3 = AgCl ↓ tr¾ng + NO3-
AgCl tan trong NH4OH, KCN, Na2S2O3... ®Ó t¹o thµnh c¸c phøc tan.
−
Víi Pb2+
2Cl- + Pb2+ = PbCl 2↓ tr¾ng
PbCl2 tan trong n−íc nãng vµ kÕt tña trë l¹i khi lµm l¹nh.
−
Ph¶n øng oxy hãa:
2Cl- + PbO2 + 4H+ = Cl2 + Pb2+ + 2H2O
83

NhËn biÕt Cl2 sinh ra b»ng giÊy tÈm KI vµ hå tinh bét do:
Cl2 + 2KI = 2KCl + I2
I2 lµm xanh hå tinh bét.
2.2. Ph¶n øng cña Br-
−
Víi Ag+:
Br- + AgNO3 = AgBr ↓ vµng nh¹t + NO3-
AgBr tan trong NH4OH, KCN, Na2S2O3... ®Ó t¹o thµnh c¸c phøc tan.
−
Víi Pb2+
2Br- + Pb2+ = PbBr2↓ tr¾ng
PbBr2 tan trong kiÒm, CH3COONH4 vµ KBr d−:
PbBr2 + 2KBr = K2[PbBr4]
−
Br- t¸c dông víi n−íc clor hoÆc n−íc Javel, sinh ra Br2 :
2Br- + Cl2 = Br2 + 2Cl-
Br2 tan trong cloroform cho dung dÞch mµu vµng r¬m.
−
Víi thuèc thö h÷u c¬:
Br- + dung dÞch Fluorescein = Eosin hång
2.3. Ph¶n øng cña I-
−
Víi Ag+:
I- + AgNO3 = AgI ↓ vµng + NO3-
AgI kh«ng tan trong NH4OH, nh−ng tan trong KCN ®Ó t¹o thµnh
phøc tan.
−
Víi Hg2+:
Hg2+ + 2I- = HgI2↓ ®á cam
HgI2 + 2I- = [HgI4]2-tan, kh«ng mµu
−
Víi Cu2+:
2Cu2+ + 4I- = 2CuI↓tr¾ng + I2↓n©u sÉm
(NÕu cã lÉn SO32- th×: I2 + SO32- + H2O = I- + SO42- + 2H+)
−
Víi NaNO2 trong m«i tr−êng acid:
2I- + 2NO2- + 4H+ = I2 + 2NO + 2H2O
I2 lµm xanh hå tinh bét.
84

−
Víi n−íc clor hoÆc n−íc Javel, sinh ra I2:
2I- + Cl2 = I2 + 2Cl-
I2 tan trong cloroform (dung m«i kh«ng oxy) cho dung dÞch mµu tÝm.
NÕu Cl2 d− sÏ lµm mÊt mµu I2, v×:
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
−
Víi Fe3+:
2Fe3+ + 2I- = 2Fe2+ + I2
2.4. Ph¶n øng cña SCN-
−
Víi Ag+:
Ag+ + SCN- = AgSCN↓ tr¾ng
NÕu d− SCN- th× kÕt tña tan do t¹o phøc:
AgSCN + 2SCN- = [Ag(SCN)3]2-
−
Víi Hg2+:
Hg2+ + 2SCN- = Hg(SCN)2↓ tr¾ng
NÕu d− SCN- th× kÕt tña tan do t¹o phøc:
Hg(SCN)2 + 2SCN- = [Hg(SCN)4]2-
NÕu cã mÆt ion Co2+ th× sÏ t¹o kÕt tña xanh thÉm:
Co2+ + [Hg(SCN)4]2- = Co[Hg(SCN)4] ↓ xanh thÉm
−
Víi Fe3+:
Fe3+ + 3SCN- = Fe(SCN)3↓ ®á m¸u
NÕu d− SCN- th× kÕt tña tan do t¹o phøc tan cã mµu ®á m¸u:
Fe(SCN)3 + 3SCN- = [Fe(SCN)6]3-
2.5. Ph¶n øng cña S2O32-
−
Víi Ag+:
2Ag+ + S2O32- = Ag2S2O3↓ tr¾ng
+ Ag2S2O3 sinh ra bÞ ph©n hñy thµnh mµu vµng n©u råi chuyÓn thµnh
®en do:
Ag2S2O3 + H2O = Ag2S↓®en + H2SO4
+ Ag2S2O3 tan trong Na2S2O3 d− do t¹o thµnh phøc:
Ag2S2O3 + 3 Na2S2O3 = 2Na3[Ag(S2O3)2]
85
−
Víi Ba2+:
Ba2+ + S2O32- = BaS2O3↓ tr¾ng
KÕt tña BaS2O3 dÔ tan trong c¸c acid v« c¬ th«ng th−êng.
−
Víi acid v« c¬ lo·ng:
2H+ + S2O32- = SO2↑ + S↓ + H2O
−
Víi dung dÞch iod:
S2O32- lµm mÊt mµu dung dÞch iod do nã khö I2 ®Õn I-. Ph¶n øng nµy
cßn øng dông trong phÐp ph©n tÝch ®Þnh l−îng:
I2 + 2S2O32- = 2I- + S4O62-
Tetrathionat
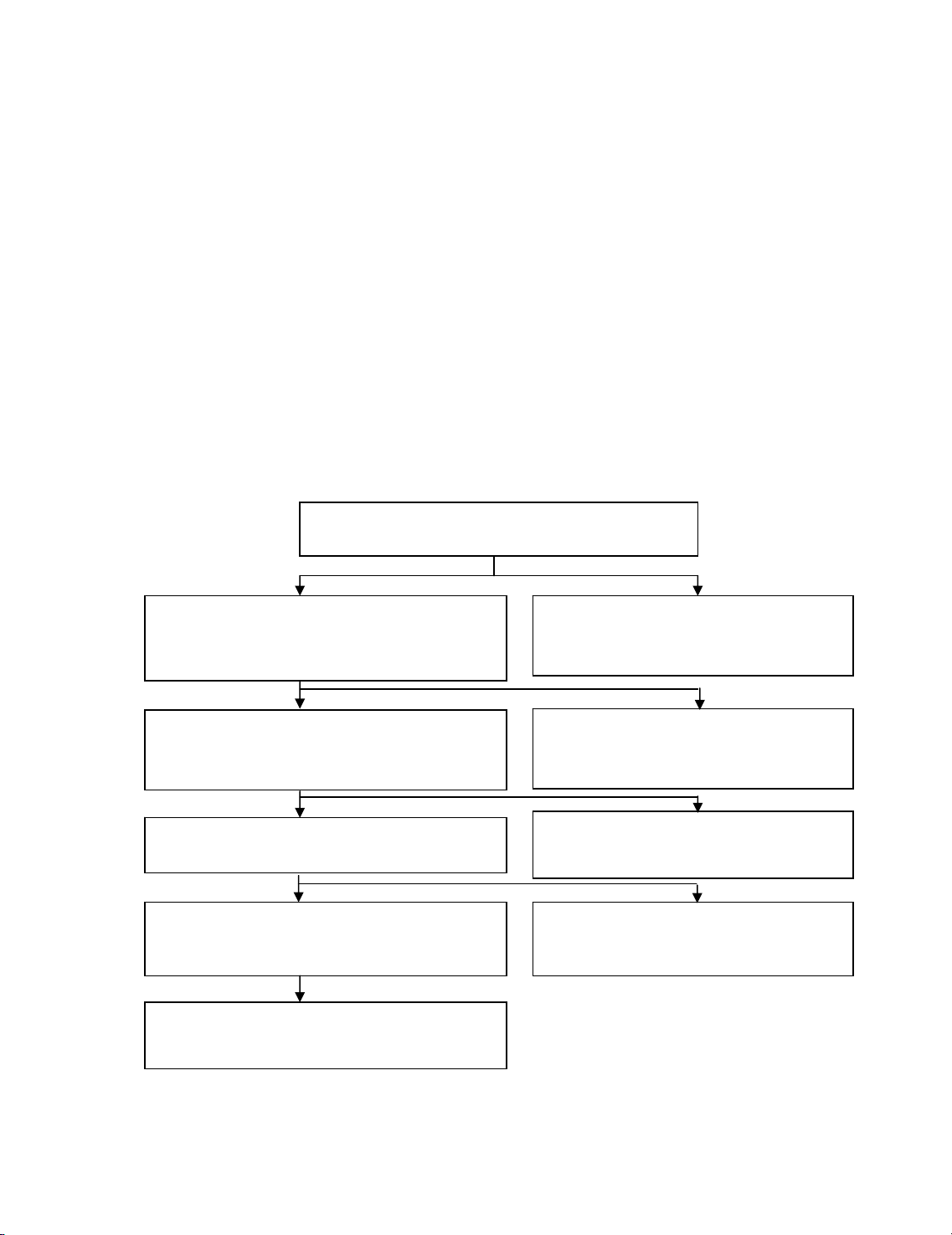
3. S¬ ®å ph©n tÝch
S¬ ®å 6*: S¬ ®å lý thuyÕt ph©n tÝch anion nhãm I Cl-, Br-, I-, SCN-, S2O32-
Dung dÞch ph©n tÝch
+ Na2CO3 (lµm n−íc soda)
N−íc ly t©m (n−íc soda):
Chøa anion nhãm I + Cation
kim lo¹i kiÒm vµ NH4+, + HNO32N + AgNO3
Tña: carbonat c¸c cation
kh«ng ph¶i kim lo¹i kiÒm
(bá ®i hoÆc ®Ó t×m c¸c cation)
Tña: Anion nhãm I
(NÕu tña tõ n©u Æ ®en lµ cã S2O32-, v×
Ag2S2O3 Æ Ag2S) Chia 2 phÇn
N−íc ly t©m:
Anion c¸c nhãm kh¸c
(bá ®i)
PhÇn lín tña:
+ (NH4)2CO3 ®un kü
PhÇn nhá tña:
t T×m SCN-
Tña: AgBr, AgI, AgSCN
(cã thÓ cßn AgCl),
+ H2SO42N + Zn h¹t
N−íc ly t©m: Br-, I-, SCN- (Cl-)
t T×m I-, Br-, SCN-
N−íc ly t©m:
[Ag(NH3)2]Cl t T×m Cl-
*. S¬ ®å thùc hµnh t−¬ng øng: xem s¬ ®å 6, PhÇn 2. Thùc hµnh ph©n
tÝch ®Þnh tÝnh
86

bµi tËp (bµi 9)
9.1. H·y hoµn thµnh c¸c ph−¬ng tr×nh ph¶n øng sau:
1) NaCl + PbO2 + HNO3 → ... +....
2) NaBr + Cl2 → ... +....
3) Hg(NO3)2 + NaId− → ... +....
4) NaI + FeCl3 → ... +....
5) NaI + NaNO2 + H2SO4 → ... +....
6) FeCl3 + NaSCNd− → ... +....
9.2. C©n b»ng c¸c ph¶n øng sau vµ cho biÕt ph¶n øng nµo cã thÓ dïng
®Ó ph¸t hiÖn ion Cl- trong dung dÞch? V× sao?
1) NaCl + AgNO3 → AgCl↓ + NaNO3
2) BaCl2 + H2SO4 → BaSO4↓ + HCl
3) CaCl2 + Na2CO3 → CaCO3↓ + NaCl
9.3. C©n b»ng c¸c ph¶n øng sau vµ cho biÕt ph¶n øng nµo cã thÓ dïng
®Ó ph¸t hiÖn ion Br- trong dung dÞch? V× sao?
1) KBr + Pb(NO3)2 → PbBr2 ↓ + KNO3
2) SrBr2 + Na2SO4 → NaBr + SrSO4 ↓
3) AlBr3 + NaOH → NaBr + Al(OH)3 ↓
9.4. C©n b»ng c¸c ph¶n øng sau vµ cho biÕt ph¶n øng nµo cã thÓ dïng
®Ó ph¸t hiÖn ion I- trong dung dÞch? V× sao?
1) NaI + NaNO2 + HNO3→ NaNO3 + I2 + H2O
2) ZnI2 + NH4OH → [Zn(NH3)4](OH)2 + NH4I + H2O
3) BaI2 + K2CO3 → BaCO3 ↓ + KI
9.5. C©n b»ng c¸c ph¶n øng sau vµ cho biÕt ph¶n øng nµo cã thÓ dïng
®Ó ph¸t hiÖn ion SCN- trong dung dÞch? V× sao?
1) KSCN + FeCl3 → K3[Fe(SCN)6] + KCl
2) Ca(SCN)2 + (NH4)2SO4 → CaSO4↓ + NH4SCN
3) Ba(SCN)2 + Na3PO4 → Ba3(PO4) 2↓ + NaSCN
9.6. C©n b»ng c¸c ph¶n øng sau vµ cho biÕt ph¶n øng nµo cã thÓ dïng
®Ó ph¸t hiÖn ion S2O32- trong dung dÞch? V× sao?
1) Na2S2O3 + AgNO3 → Ag2S2O3 + NaNO3
2) SrS2O3 + K2CO3 → K2S2O3 + SrCO3
3) K2S2O3 + BaCl2 →BaS2O3 + KCl
9.7. V× sao cã thÓ dïng n−íc Javel hoÆc n−íc clor võa ®ñ ®Ó ph¸t hiÖn I-,
sau ®ã cho d− n−íc Javel hoÆc d− n−íc clor ®Ó ph¸t hiÖn tiÕp Br- ?
87



![Đề cương ôn tập Hóa phân tích [năm] chi tiết, chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250629/sonvu86/135x160/6131751251868.jpg)



















![Bài giảng Hình học họa hình: Bài mở đầu - Giới thiệu [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250823/kimphuong1001/135x160/99131755935505.jpg)


