
HOÙA ÑAÏI CÖÔNG nvhoa102@yahoo.com Ch
ươ
ng 1
1
CHÖÔNG 1
CẤU TẠO NGUYEÂN TỬVAØ
HEÄ THOÁNG TUAÀN HOAØN
CAÙC NGUYEÂN TOÁ HOÙA HOÏC

HOÙA ÑAÏI CÖÔNG nvhoa102@yahoo.com Ch
ươ
ng 1
2
I.1. NHÖÕNG KHAÙI NIEÄM VAØ ÑÒNH LUAÄT CÔ SÔÛ
-Nguyeân töû, phaân tử
-Nguyeân tửgam, phaân töû gam
-Mol
-Ñöông löôïng vaø ñònh luaät ñöông löôïng
töï ñoïc
HOÙA ÑAÏI CÖÔNG nvhoa102@yahoo.com Ch
ươ
ng 1
3
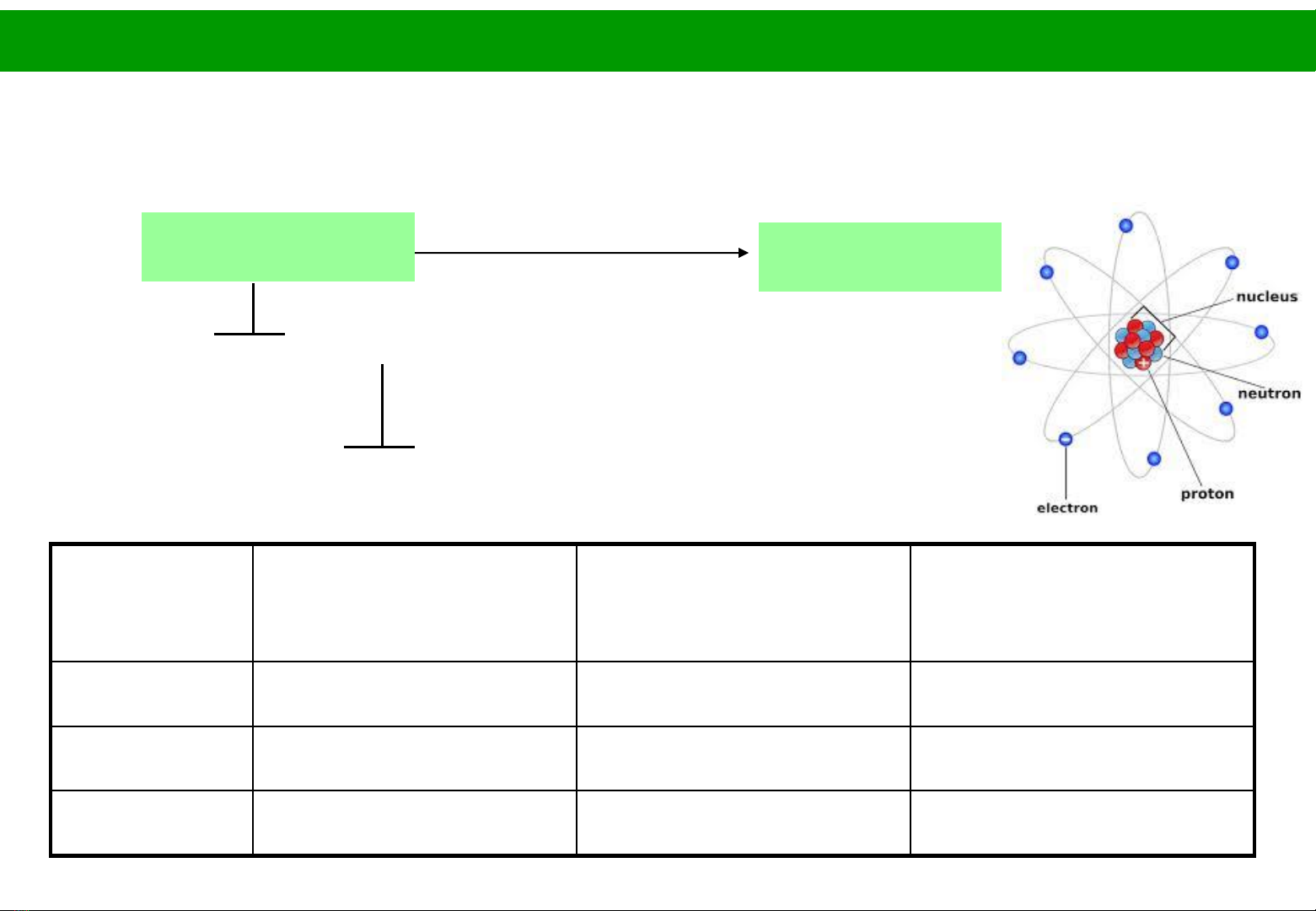
I.2. KHAÙI NIEÄM VEÀ NGUYEÂN TÖÛ
Haït Khoái löôïng
tuyeät ñoái (kg) Khoái löôïng
töông ñoái (ñvC)Ñieän tích (ÑV e)
Electron 9,109390.10-31 0,000549 0- 1
Proton 1,672623.10-27 1,007277 1+ 1
Neutron 1,674929.10-27 1,008665 10
Nguyeân töû Caùc chaát
Haït vaät chaát
Electron Haït Nhaân
Haït proton Haït neutron
(Z) + (N) = (A)
(e)
HOÙA ÑAÏI CÖÔNG nvhoa102@yahoo.com Ch
ươ
ng 1
4
Câu 1. Trong các phát biểu cho sau đây, các phát biểu đúng là:
1) Các nguyên tử có cùng điện tích hạt nhân Z và có số khối A
khác nhau được gọi là các đồng vị.
2) Hạt nhân nguyên tử của các đồng vị của một nguyên tố có số
nơtron khác nhau.
3) Nguyên tử lượng của một nguyên tố trong bảng hệ thống tuần
hoàn là trung bình cộng của nguyên tử lượng của các đồng vị
theo tỷ lệ tồn tại trong tự nhiên.
4) Trừ đồng vị có nhiều nhất của một nguyên tố X, các đồng vị
khác đều là những đồng vị phóng xạ.
a)
1
b)
1,2
c)
1,4
d)
1,2,
3

HOÙA ÑAÏI CÖÔNG nvhoa102@yahoo.com Ch
ươ
ng 1
5
Câu 2 Khối lượng nguyên tử của đồng vị 12H gồm:
a) Khối lượng của 1 proton + 1 nơtron
b) khối lượng của electron
c) khối lượng của electron + 1 nơtron
d) khối lượng của 1 proton
Câu 3 Chọn phát biểu đúng về tính chất của các đồng vị của cùng 1 nguyên
tố:
a) Các đồng vị của cùng một nguyên tố thì giống nhau về tất cả các tính chất
lí, hóa học.
b) Các nguyên tử có cùng điện tích hạt nhân, có số khối như nhau được gọi
là các đồng vị.
c) Các đồng vị có cùng số proton và cùng số nơtron.
d) Đồng vị chiếm cùng một ô trong bảng hệ thống tuần hoàn các nguyên tố.


























