BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC PHENIKAA
1
HỌC PHẦN HÓA HỌC ĐẠI CƯƠNG
BÀI GIẢNG
Dung dịch
7
Liên kết hóa học và cấu tạo phân tử
2
Nguyên lý II của nhiệt động học
5
Cân bằng hóa học
6
4Nguyên lý I của nhiệt động học
Cấu tạo nguyên tử
1
Động hóa học
9
10 Các quá trình điện hóa
Trạng thái tập hợp của chất
3
Dung dịch chất điện ly
8
Dung dịch
7
Liên kết hóa học và cấu tạo phân tử
2
Nguyên lý II của nhiệt động học
5
Cân bằng hóa học
6
4Nguyên lý I của nhiệt động học
Cấu tạo nguyên tử
1
Động hóa học
9
10 Các quá trình điện hóa
Trạng thái tập hợp của chất
3
Dung dịch chất điện ly
8

Mẫu nguyên tử cổ điển
2
3
Quy luật phân bố các electron trong nguyên tử
4
Hệ thống tuần hoàn các nguyên tố hóa học
5
Đại cương về cơ học lượng tử
Thành phần
1
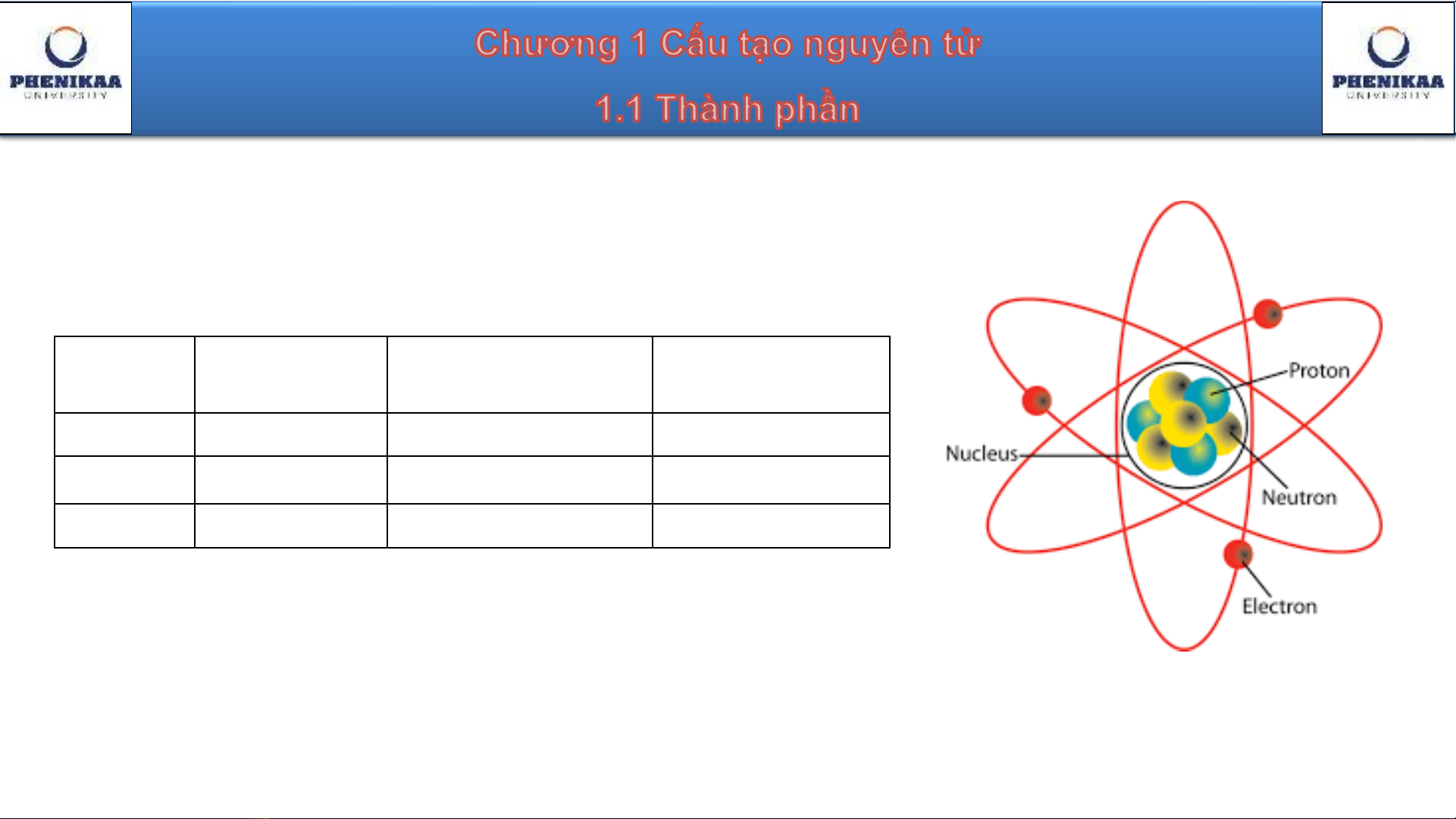
The atom
Các hạt cơ bản trong nguyên tử
Hạt
Điện
tích (C)
Khối
lượng (amu)
Khối
lượng (kg)
Electron
-
1.602x10-19
5.486x10
-4
9.1095x10
-31
Proton
1.602x10
-19
1.0073
1.6726x10
-27
Neutron
0
1.0087
1.6750x10
-27
amu (atomic mass unit) = 1.66054x10-24 gam


























