
1
Chương 1: Sự hình thành lớp mạ điện
1.1. Điều kiện tạo thành lớp mạ
Mạ điện thực chất là một quá trình điện phân. Quá trình tổng quát là:
+ Ở anot xảy ra quá trình hoà tan kim loại:
M – ne Mn+ (1.1)
+ Ở catot, cation phóng điện thành nguyên tử kim loại mạ:
Mn+ + ne M (1.2)
Trên thực tế các ion trong dung dịch không nằm tự do mà dưới dạng hidrat
hoá Mn+ .m H2O. Phản ứng catot xảy ra gồm nhiều giai đoạn nối tiếp nhau:
+ Cation hidrat hoá Mn+ .m H2O di chuyển từ dung dịch đến bề mặt catot
+ Dưới tác dụng của điện trường thì Mn+ tách vỏ hidrat để tồn tại dưới dạng tự
do Mn+, tiếp xúc trực tiếp với bề mặt catot.
+ Mn+ nhận điện tử tạo thành nguyên tử kim loại M
+ Các nguyên tử kim loại M liên kết với nhau để hoặc tạo thành mầm tinh thể
mới hoặc tham gia nuôi lớn mầm tinh thể đã sinh ra trước đó. Các mầm tinh thể phát
triển dần thành tinh thể, tinh thể liên kết với nhau để tạo thành lớp mạ.
Tốc độ chung của quá trình catot (1.2) nhanh hay chậm phụ thuộc vào giai
đoạn nào có tốc độ chậm nhất. Mọi trở lực của các bước trên đều được thể hiện ở độ
phân cực catot (quá thế catot c) tức là điện thế catot dịch về phía âm hơn một lượng
c so với cân bằng. Để các giai đoạn trên xảy ra thì phải cung cấp một năng lượng
để thắng các trở lực. Năng lượng này được thể hiện bởi đại lượng gọi là quá thế hay
phân cực:
ηc = cb - (1.3)
Trong đó: ηc – Quá thế catot, V
cb - Điện thế cân bằng của catot, V
- Điện thế phân cực catot (khi có dòng điện i chạy qua), V
Giữa phân cực catot (quá thế catot) và cấu trúc kết tủa (lớp mạ) có quan hệ
chặt chẽ với nhau: Phân cực catot càng lớn tinh thể càng nhỏ mịn.
Vậy mọi yếu tố kỹ thuật làm tăng phân cực catot đều cho cấu trúc tinh thể lớp
mạ được tinh tế hơn, nhỏ mịn hơn
Tuỳ vào bản chất của trở lực mà người ta phân biệt thành nhiều dạng quá thế
khác nhau: quá thế khuếch tán, quá thế chuyển đổi, quá thế kết tinh, quá thế điện
hóa, quá thế hóa học, quá thế nồng độ…Trong mạ điện thường gặp các loại quá thế
sau:
1.1.1.Quá thế khuếch tán ηkt
Quá thế khuếch tán phát sinh khi nồng độ cation trong lớp kép giảm mà
khuếch tán không bù kịp. Quá thế khuếch tán ηkt được tính bằng phương trình:
kt = (RT/nF) ln(C1/C0) (1.4)
Trong đó:
C1- Nồng độ cation của kim loại kết tủa trong lớp sát catot
C0- Nồng độ của cation ấy trong khối dung dịch
n- Số điện tử trao đổi của cation
R- Hằng số khí (8,314j/mol0. K)
T- Nhiệt độ tuyệt đối, 0K

2
F- Hằng số Faraday (96500 culong)
- Mặt khác: C1 =C0(1 - i/igh) (1.5)
Trong đó i là mật độ dòng điện làm phân cực điện cực;
igh là mật độ dòng điện giới hạn igh= KC0 (1.6)
K là hằng số.
Thay (1.5) vào (1.4) ta được
kt = (RT/nF) ln(1 - i/igh) (1.7)
Chú ý: Nếu ta theo quy ước: Quá thế luôn luôn là đại lượng dương, thì các
phương trình (1.4), (1.7)… viết cho trường hợp catot đều phải lấy giá trị dương của
vế phải.
Như vậy từ phương trình (1.7) ta có nhận xét sau:
- Trong mạ điện luôn phải dùng i<igh nhưng trong sản xuất, để tăng tốc độ mạ
thường có xu hướng tranh thủ dùng i igh. Tức là dùng i càng cao thì kt càng lớn.
Khi tăng T thì kt tăng nhưng T tăng thì igh tăng và thường có kết cục kt giảm.
- Khi tăng cường độ khuấy trộn thì igh tăng dẫn đến kt giảm. Vậy tăng T và
khuấy thường làm cho kết tủa gồm các tinh thể to, thô, do hiệu ứng giảm kt chiếm
ưu thế hơn.
- Quá thế khuếch tán giữ phần chủ yếu trong quá thế nồng độ nđ. ( vận
chuyển cation tới bề mặt catot ngoài do khuếch tán còn do điện trường và do đối
lưu)
1.1.2. Quá thế chuyển đổi ηcđ
Quá thế chuyển đổi phát sinh do chậm khử vỏ hidrat hoặc các ligan trong nội
cầu phức (quá thế hoá học) hoặc do chậm phóng điện (quá thế điện hoá). Nó được
xác định bằng công thức Tafel:
= a + b lgi (1.8)
Trong đó
i là mật độk dòng, A/dm2
a, b là các hằng số xác định bằng thực nghiệm
a- phụ thuộc vào i0, T
b- phụ thuộc vào T
Nếu khâu phóng điện là chậm nhất, ta có quá thế điện hóa đh
1.1.3. Quá thế kết tinh k
Quá thế kết tinh phát sinh do nguyên tử kim loại vừa được giải phóng chậm
tham gia kết thành mạng lưới tinh thể. Quá thế kết tinh có quan hệ với dòng điện
trao đổi i0 của kim loại ấy.
Quan hệ giữa quá thế kết tinh k, dòng điện trao đổi và cỡ hạt tinh thể thể hiện
rất rõ trong các trường hợp kết tủa kim loại từ dung dịch muối đơn (vì khi đó các
quá thế nồng độ, điện hóa… đều bé).
Căn cứ vào giá trị quá thế kết tinh chia kim loại thành 3 loại như bảng 1.1.
Thấy rằng quá thế kết tinh k phụ thuộc vào bản chất kim loại và tỉ lệ nghịch
với dòng trao đổi i0. i0 càng lớn thì quá thế kết tinh càng nhỏ.
Vậy quá thế chung của quá trình catot bằng:
ηc = nđ + ηcđ + k (1.9)

3
Bảng 1.1. Quan hệ giữa quá thế kết tinh, dòng trao đổi và cỡ hạt
Nhóm
i0, A/cm2
k, V
Chiều dài tinh thể
Ag, Cd, Sn...
10-1 – 10-2
10-3
>10-3
Bi, Cu, Zn...
10-4 – 10-5
10-2
10-3 – 10-4
Co, Fe, Ni....
10-8 – 10-9
10-1
10-5 – 10-6
Do đó, điện kết tủa kim loại trên catot sẽ diễn ra khi nào điện thế catot dịch
khỏi vị trí cân bằng và chuyển về phía âm một đại lượng ηc đủ để khắc phục các trở
lực nói trên.
1.2. Cơ chế tạo thành lớp mạ điện
1.2.1. Điều kiện xuất hiện tinh thể
Lớp mạ điện có cấu trúc tinh thể rất điển hình, vì thế trong quá trình khử catot
các kim loại được gọi là quá trình điện kết tủa kim loại, mà trong thực tế thường
được gọi là mạ điện. Lớp mạ có cấu trong tinh thể càng nhỏ mịn xít chặt thì chất
lượng của nó càng cao.
Giống như các quá trình kết tinh từ dung dịch quá bão hoà, từ chất nóng
chảy... thì động học của quá trình bị chi phối bởi 2 yếu tố chính: tốc độ tạo mầm tinh
thể v1 (hay các trung tâm kết tinh) và tốc độ phát triển các mầm tinh thể đó v2.
+ Nếu v1> v2 thì tinh thể tạo thành nhỏ mịn cho lớp mạ kín, sít, chặt, cứng
+ Nếu v1 < v2 thì tinh thể tạo thành thô, to cho lớp mạ mềm, xốp, hở
Trong trường hợp kết tinh từ dung dịch quá bão hoà thì yếu tố quyết định tốc
độ tạo mầm tinh thể là độ quá bão hoà của dung dịch, biểu thị bằng tỷ số
= C/C0
Trong đó: C - Nồng độ của dung dịch quá bão hoà
C0 - Nồng độ cân bằng của dung dịch bão hoà
Nếu càng lớn hơn 1, tốc độ tạo mầm càng lớn và do đó tinh thể trong kết tủa
càng nhỏ.
Trường hợp kết tinh từ chất nóng chảy C thì độ quá nguội giữ vai trò của
nói trên.
Đối với trường hợp điện kết tủa kim loại trên catot thì yếu tố quyết định đến
tốc độ xuất hiện mầm tinh thể là tỷ số giữa mật độ dòng điện catot Dc với mật độ
dòng trao đổi i0:
= Dc/i0. (1.10)
Chú ý: Trong kỹ thuật mạ điện hay dùng ký hiệu Dc, Da để chỉ mật độ dòng điện
catot hoặc anot.
Vì dòng điện trao đổi i0 phụ thuộc vào bản chất kim loại (bảng 1.1), nên ở
cùng một mật độ dòng điện catot Dc thì kim loại nào có i0 bé hơn sẽ cho lớp mạ có
tinh thể nhỏ mịn hơn, và ngược lại.
Đối với cùng một kim loại (i0= const), nếu tăng mật độ dòng catot Dc (trong
một giới hạn nào đó) cũng sẽ được tinh thể nhỏ mịn.
Liên hệ với phương trình Tafel:
= a + blgDc (1.11)
Thấy rằng i0 (ẩn trong a) và Dc đều ảnh hưởng đến phân cực catot . Vậy nếu i0 và
Dc đã có thể làm tăng được thì cũng sẽ phải làm tăng , bởi lẽ tăng hoặc đều
cho cùng một kết quả là kết tủa tinh thể nhỏ mịn.
4
Như vậy nếu >> 1 thì v1 >> v2, tức càng tăng Dc trong một giới hạn nào đó thì
tinh thể càng nhỏ mịn.
Mặt khác, theo phương trình Butlervolmer thì ta có mối quan hệ giữa và
dòng i:
i = ia + ic =io (enf - e-(1-)nf )
Trong đó:
ia - Mật độ dòng anot
ic - Mật độ dòng catot
n - Hoá trị trao đổi của cation
- Hệ số chuyển điện tích
Khi phân cực catot: ia 0
i = ic = - io e-(1-)nf
ln/ic/ = ln i0 – (1-)nfc
c = lnio / (1-)nf - ln/ic/ / (1-)nf
= - ln (/ic/ / i0) / (1-)nf = - ln (Dc / i0) / (1-)nf
= -ln / (1-)nf
Như vậy, khi phân cực c càng lớn thì càng lớn tức tốc độ tạo mầm càng lớn
dẫn đến cấu trúc tinh thể càng nhỏ mịn, sít chặt và ngược lại.
Suy rộng ra, mọi yếu tố làm tăng phân cực catot đều làm cho lớp mạ có tinh
thể nhỏ mịn, và ngược lại. Trong thực tế điện phân có rất nhiều yếu tố (ngoài i0 và
Dc) ảnh hưởng đến phân cực catot. Cho nên nếu chọn được thành phần dung dịch,
chế độ điện phân, điều kiện công nghệ... làm tăng phân cực catot đến mức độ thích
hợp cũng đều thu được kết tủa có cấu tạo tinh thể và chất lượng lớp mạ theo ý muốn.
1.2.2. Quá trình hình thành tinh thể và tổ chức tinh thể
a. Sự hình thành tinh thể: Không phải mọi mầm tinh thể sinh ra đều được phát
triển thành tinh thể cả. Chỉ những mầm có kích thước lớn hơn một ngưỡng nào đó
mới có khả năng phát triển thành tinh thể được. Để sinh ra được mầm đạt hoặc vượt
ngưỡng ấy đòi hỏi phải có một quá thế bổ sung (tức cần cung cấp thêm năng lượng),
điều đó có thể thực hiện được nếu bề mặt điện cực bị thụ động nhẹ. Còn khi tinh thể
lớn lên (phát triển mầm) chỉ đòi hỏi một quá thế bình thường (không cần quá thế bổ
sung nữa) vì bề mặt tinh thể ở trạng thái hoạt động. Các tinh thể này thường được
nuôi lớn lên đến cỡ 10-5 – 10-3 cm. Hình thù của chúng không giống hệt nhau vì
trong lúc phát triển mầm chúng tự chèn ép lẫn nhau mà biến dạng đi.
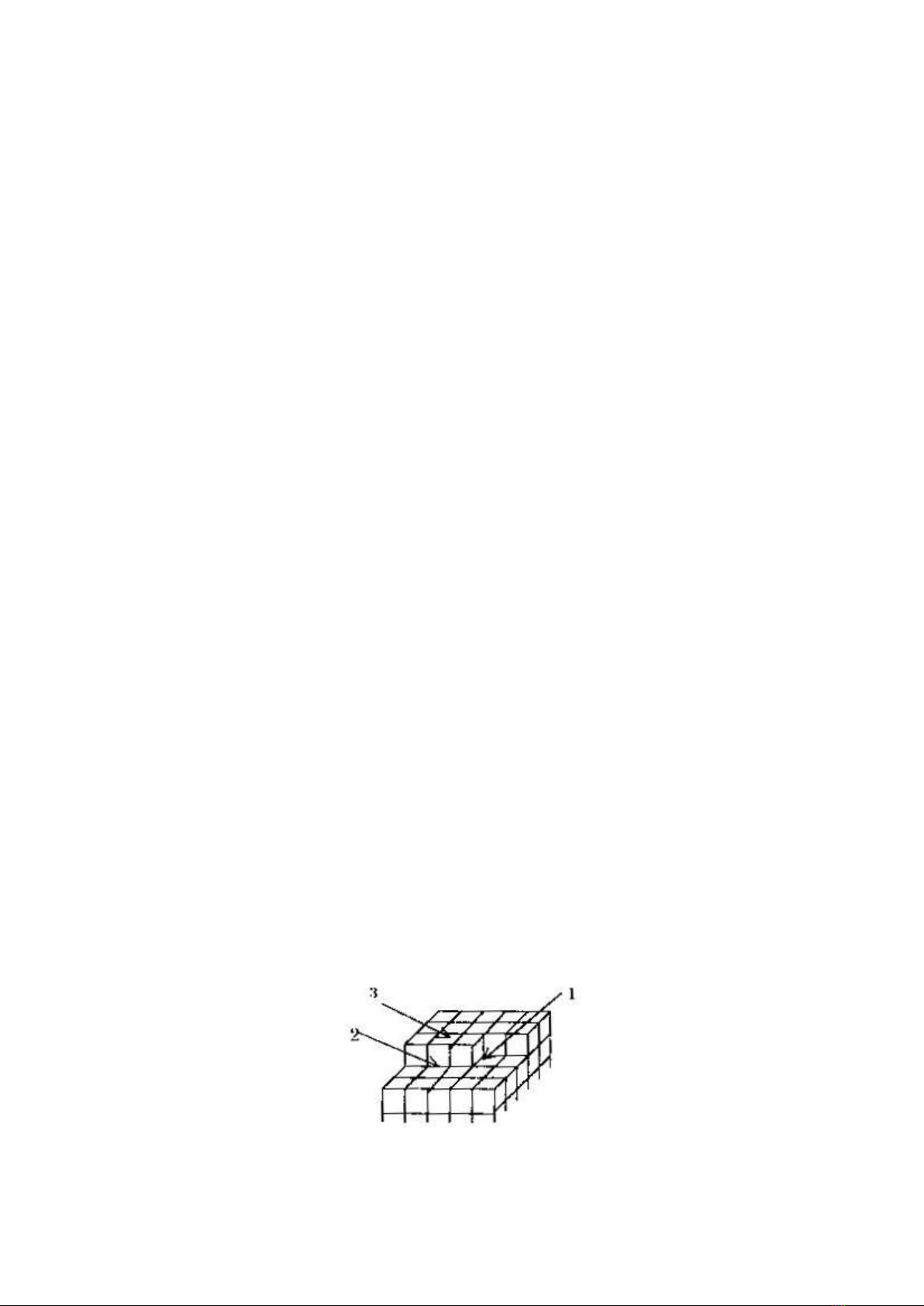
Mầm phát triển thành tinh thể diễn ra như sau: Giả sử tinh thể có kiểu ô mạng
là hình khối đơn giản như hình 1.1.
Hình 11. Sơ đồ phát triển mầm tinh thể
1- Chỗ hoạt động nhất; 2 – Chỗ hoạt động trung bình
3- Chỗ hoạt động kém nhất

5
Các cation phóng điện thành nguyên tử kim loại và tham gia vào mạng lưới
tinh thể ở vị trí nào có lợi về năng lượng nhất. Đó chính là chỗ tập trung nhiều
nguyên tử láng giềng nhất, vì ở đó năng lượng dư bề mặt lớn nhất, các mối liên kết
chưa được sử dụng là nhiều nhất.
Trên hình 1.1: Góc 1 dễ tiếp nhận nguyên tử mới phóng điện vào mạng tinh
thể nhất sau đó là bậc 2 và cuối cùng là mặt 3. Kết quả là tinh thể lan theo hai chiều
thành một mặt mới, chỉ khi nào trên mặt 3 xuất hiện 1 nguyên tử mới thì kết tủa lại
lan theo 2 chiều thành một mặt khác (tức lớp nguyên tử khác). Cứ như vậy, các mặt
mạng kế tiếp nhau xuất hiện và tinh thể được lớn lên. Cũng có khi trên mặt 3 xuất
hiện nhiều nguyên tử mới chồng chất vô trật tự lên nhau (do có hấp phụ tạp chất
chẳng hạn), từ đó chúng sẽ lan ra thành lớp đa nguyên tử. Các lớp trên chỉ phát triển
trong phạm vi một tinh thể. Các trung tâm khác cũng phát triển đồng thời như vậy
thành các tinh thể khác. Chúng phát triển dần và tiếp giáp nhau bằng các tinh giới và
hợp thành lớp kim loại kết tủa.
Ban đầu khi tinh thể còn nhỏ, chúng cách biệt nhau nên hình dạng của chúng
vẫn khá chuẩn mực. Các mặt bên của tinh thể lớn lên theo từng lớp lan đến biên giới
của nó. Chiều dày và tốc độ lan của mỗi lớp phụ thuộc vào nồng độ ion, chất hoạt
động bề mặt, chế độ điện phân.
Trong quá trình lớn lên của tinh thể hình dạng của nó biến đổi dần. Có nhiều
nguyên nhân, nhưng trước hết phải kể đến hiện tượng lệch mạng. Do nhiều tác động
khiến một số nguyên tử không được sắp xếp vào đúng bị trí vốn có của chúng mà
xếp lệch so với các nguyên tử khác, làm xuất hiện bậc OA thẳng (hình 1.2). Khi tiếp
tục lớn lên chủ yếu bằng cách tiếp nhận trực tiếp các nguyên tử mới giải phóng vào
các bậc ấy, và lệch xoắn cứ tồn tại mãi chừng nào bề mặt tinh thể chưa bị thụ động.
Quan sát bề mặt mạ thấy mật độ lệch rất lớn, đến 1011 - 1012 lệch/cm2. Tại các bậc
của lệch cũng dễ bị hấp phụ các nguyên tử, phân tử, ion lạ, các chất hoạt động bề
mặt vào, làm thay đổi rất rõ các tính chất cơ lý của lớp mạ như tính chất quang học,
bán dẫn, dẫn điện, độ cứng, độ dẻo, độ bóng,...
Hình 1.2. Các giai đoạn tạo thành lệch xoắn
b. Tổ chức tinh thể
Lớp mạ là do vô vàn các tinh thể hợp lại mà thành. Kích thước tinh thể và
cách sắp xếp của chúng sẽ quyết định tính chất và chất lượng lớp mạ.
- Kích thước tinh thể:
Ta đã biết, để có tinh thể nhỏ mịn phải tạo được điều kiện để có phân cực đủ
lớn. Chất hoạt động bề mặt là một trong các biện pháp thường dùng để tăng phân
cực catot. Các chất này thường hấp phụ điểm lên catot làm thụ động cục bộ và tạm
thời. Những chỗ chưa bị hấp phụ mật độ dòng điện thực tế tăng lên làm cho phân
cực cục bộ tăng theo (1.11), do đó mầm tinh thể lớn mới sinh ra tại đây dễ hơn (vì
có quá thế bổ sung). Đến lúc nào đó nồng độ ion kim loại trong lớp dung dịch sát
chỗ catot có tinh thể đang lớn lên ấy sẽ nghèo đi, đồng thời mật độ dòng điện thực tế


























