
®Þnh l−îng b»ng ph−¬ng ph¸p kÕt tña -
®Þnh l−îng b»ng ph−¬ng ph¸p t¹o phøc
Môc tiªu
1. Tr×nh bµy ®−îc kh¸i niÖm vÒ tÝch sè tan, ®é tan vµ øng dông trong ph©n tÝch.
2. M« t¶ ®−îc kü thuËt ®Þnh l−îng b»ng b¹c trong ph−¬ng ph¸p Mohr, Fonha,
Faian. TÝnh ®−îc kÕt qu¶ cña phÐp chuÈn ®é.
3. Tr×nh bµy ®−îc ®Þnh nghÜa phøc chÊt, h»ng sè bÒn v÷ng cña phøc vµ ý nghÜa.
4. HiÓu vµ chän ®−îc chÊt chØ thÞ ®Ó ®Þnh l−îng b»ng ph−¬ng ph¸p t¹o phøc víi
complexon. TÝnh ®−îc kÕt qu¶ ®Þnh l−îng.
1. chuÈn ®é kÕt tña
1.1. Mét sè kh¸i niÖm c¬ b¶n
1.1.1. TÝch sè tan (T):
−
XÐt hÖ gåm tña AmBn tan trong n−íc ®Õn b·o hßa, cã c¸c c©n b»ng sau:
Hßa tan: AmBn ↓ AmBn víi K1=[AmBn]
Ph©n ly: AmBn mA + nB víi K2=
[][]
[]
nm
nm
BA BA .
Tæng: A
m
B
n
↓ mA + nB víi K = K
1
.K
2
=[A]
m
.[B]
n
= T lµ mét
h»ng sè ë mét nhiÖt ®é nhÊt ®Þnh vµ ®−îc gäi lµ tÝch sè tan.
−
BiÕt tÝch sè tan, ta cã thÓ biÕt ®−îc tr¹ng th¸i c©n b»ng cña mét hÖ ë
mét ®iÒu kiÖn nµo ®ã dùa trªn c¬ së sau:
+ Khi [A]
m
.[B]
n
= T ta nãi hÖ ®¹t tr¹ng th¸i c©n b»ng gi÷a kÕt tña vµ
hßa tan.
+ Khi [A]
m
.[B]
n
> T hÖ ch−a c©n b»ng (sÏ cã kÕt tña hoÆc kÕt tña thªm
gäi lµ dung dÞch qu¸ b·o hßa.
188
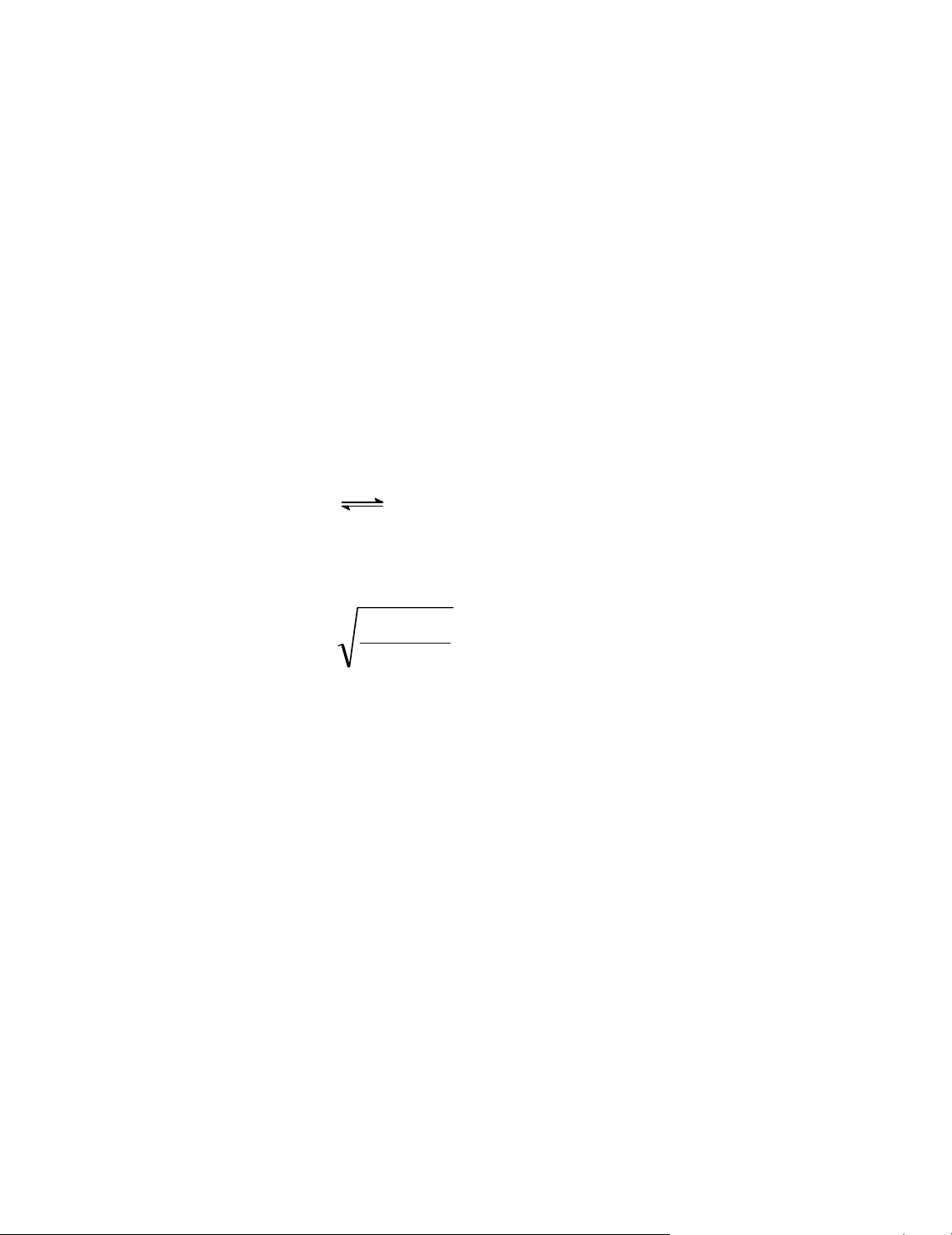
+ Khi [A]m.[B]n < T hÖ ch−a c©n b»ng (sÏ kh«ng cã kÕt tña hoÆc nÕu ®·
cã kÕt tña s½n th× kÕt tña sÏ tiÕp tôc tan ra), gäi lµ dung dÞch ch−a
b·o hßa.
Nh− vËy khi biÕt tÝch sè tan cã thÓ suy ra ®iÒu kiÖn ®Ó hßa tan kÕt tña
hoÆc lµm tña hoµn toµn (®Ó kÕt tña hoµn toµn th−êng cho d− thuèc thö).
1.1.2. §é tan (S)
−
§é tan cña mét chÊt lµ nång ®é cña chÊt ®ã trong dung dÞch b·o hoµ.
−
Nh− vËy ®é tan vµ tÝch sè tan lµ nh÷ng ®¹i l−îng ®Æc tr−ng cho dung
dÞch b·o hoµ, cho nªn chóng cã mèi quan hÖ t−¬ng hç nhau, cã thÓ
tÝnh ®−îc ®é tan tõ tÝch sè tan vµ ng−îc l¹i.
−
§é tan cña c¸c chÊt trong dung dÞch n−íc nguyªn chÊt:
Gäi ®é tan cña tña AmBn trong n−íc nguyªn chÊt lµ S (mol/l). Theo
ph−¬ng tr×nh ph©n ly:
A
mBn ↓ mA + nB
Ta cã: [A] = mS, [B] = nS. Khi ®ã:
nmBA
T =[A]m.[B]n = (mS)m.(nS)n = mm.nn.Sm+n
Do vËy: S = nm nm BA nm
Tnm
+
.
−
Tõ c«ng thøc tÝnh ®é tan S, ta thÊy nÕu c¸c kÕt tña cã cïng d¹ng ph©n
ly, tña nµo cã tÝch sè tan lín sÏ cã ®é tan lín vµ ng−îc l¹i. §ång thêi,
nÕu trong dung dÞch cã mÆt nhiÒu chÊt cïng cã kh¶ n¨ng t¹o ra c¸c
d¹ng kÕt tña kh¸c nhau víi chÊt cÇn ph©n tÝch th× d¹ng tña nµo cã
tÝch sè tan nhá h¬n sÏ dÔ kÕt tña h¬n.
1.1.3. øng dông trong ph©n tÝch
Dùa trªn c¬ së tÝch sè tan hoÆc ®é tan ta cã thÓ suy ra ®iÒu kiÖn ®Ó cã
thÓ kÕt tña hay hßa tan tña. Tõ ®ã cã thÓ ¸p dông trong ph©n tÝch ®Ó:
−
KÕt tña hoµn toµn mét chÊt tõ dung dÞch ta cÇn ph¶i t¹o c¸c ®iÒu kiÖn
®Ó cµng lµm gi¶m ®é tan cña tña cµng tèt: th−êng dïng d− thuèc thö
(trõ víi tña l−ìng tÝnh sÏ lµm tan tña xÐt riªng), lùa chän pH thÝch
hîp, tr¸nh c¸c chÊt l¹…
−
Muèn hßa tan hoµn toµn mét tña khã tan trong n−íc, ta ph¶i t×m mäi
c¸ch ®Ó lµm t¨ng ®é tan cña nã: Th−êng cã thÓ t¨ng nhiÖt ®é, thªm
chÊt ®iÖn ly, dïng acid, dïng base, dïng chÊt t¹o phøc, dïng chÊt oxy
hãa thÝch hîp hoÆc chuyÓn tña khã hßa tan thµnh tña dÔ hßa tan.
189

−
øng dông c¸c ph¶n øng kÕt tña ®Ó ®Þnh l−îng c¸c chÊt.
1.2. Ph−¬ng ph¸p chuÈn ®é kÕt tña
1.2.1. Nguyªn t¾c chung
Lµ ph−¬ng ph¸p ®Þnh l−îng dùa trªn c¸c ph¶n øng t¹o thµnh c¸c chÊt
kÕt tña (chÊt Ýt tan).
Yªu cÇu cña ph¶n øng muèn dïng ®Ó ®Þnh l−îng ph¶i:
−
Cã kh¶ n¨ng kÕt tña hoµn toµn chÊt cÇn x¸c ®Þnh (tña cã tÝch sè tan
cµng nhá cµng tèt).
−
Ph¶n øng ph¶i x¶y ra ®ñ nhanh
−
Cã tÝnh chän läc cao (chØ cho kÕt tña víi chÊt cÇn x¸c ®Þnh, kh«ng kÕt
tña víi c¸c chÊt l¹ kh¸c).
−
Chän ®−îc chØ thÞ x¸c ®Þnh ®iÓm t−¬ng ®−¬ng.
NhiÒu ph¶n øng t¹o chÊt kÕt tña rÊt nhiÒu, song chØ cã rÊt Ýt ph¶n
øng ®−îc øng dông trong phÐp chuÈn ®é bëi v×:
−
NhiÒu ph¶n øng kÕt tña x¶y ra rÊt chËm, kh«ng thÝch hîp cho phÐp
ph©n tÝch, nhÊt lµ víi c¸c dung dÞch lo·ng.
−
C¸c kÕt tña kh«ng cã thµnh phÇn x¸c ®Þnh do hiÖn t−îng hÊp phô,
céng kÕt.
−
Kh«ng chän ®−îc chØ thÞ thÝch hîp.
V× vËy trong thùc tÕ, ®Þnh l−îng b»ng ph−¬ng ph¸p kÕt tña ®−îc sö
dông nhiÒu nhÊt lµ ph−¬ng ph¸p b¹c, trong ®ã sö dông Ag+ (dung dÞch
AgNO3) ®Ó x¸c ®Þnh c¸c halogenid vµ CNS- (hoÆc ng−îc l¹i) dùa trªn ph¶n
øng:
Ag+ + X- = AgX↓
Trong ®ã X- lµ halogenid hoÆc CNS-.
Ngoµi ph−¬ng ph¸p ®Þnh l−îng b»ng Ag, cßn cã ph−¬ng ph¸p ®Þnh
l−îng b»ng thuû ng©n (I).
1.2.2. C¸c ph−¬ng ph¸p (kü thuËt) ®Þnh l−îng b»ng b¹c
§−îc gäi tªn tuú theo c¸ch chän chÊt chØ thÞ ®Ó nhËn ra ®iÓm t−¬ng
®−¬ng. Th−êng cã 3 ph−¬ng ph¸p:
a. Ph−¬ng ph¸p Mohr
Lµ ph−¬ng ph¸p ®Þnh l−îng trùc tiÕp Cl- b»ng Ag+ víi chØ thÞ lµ kali
cromat cho tña n©u ®á Ag2CrO4 ë l©n cËn ®iÓm t−¬ng ®−¬ng.
190

Ph¶n øng chuÈn ®é:
Ag+ + Cl- AgCl ↓ tr¾ng víi TAgCl = 10-10
NhËn ra ®iÓm t−¬ng ®−¬ng:
2 Ag+ + CrO42- Ag2CrO4↓n©u ®á víi 12
2.10T 4
CrO
2
Ag
−
=
§iÒu kiÖn ¸p dông:
−
Nång ®é chØ thÞ K2CrO4 cÇn 2.10-4 → 2M. Tèt nhÊt nªn dïng víi nång
®é 10-2 M → 10-3 M khi ®ã tr¸nh ®−îc mµu vµng ®Ëm cña K2CrO4 lµm
khã kh¨n cho viÖc nhËn ra ↓ Ag2CrO4.
−
pH m«i tr−êng tèt nhÊt 7 - 10,5 v× nÕu acid qu¸ sÏ kh«ng cã ↓Ag2CrO4
(do 2CrO42- + 2H+ Cr2O72- + H2O chuyÓn dÞch vÒ phÝa Cr2O72).
NÕu kiÒm qu¸ sÏ cã tña cña Ag+ víi OH-
Ag+ + OH- AgOH↓
2 AgOH↓ Ag2O↓ + H2O
b. Ph−¬ng ph¸p Fonha (Volhard)
Lµ ph−¬ng ph¸p chuÈn ®é Ag+ b»ng SCN− víi chØ thÞ lµ Fe3+ cho sù t¹o
phøc Fe(CNS)2+ mµu ®á ë l©n cËn ®iÓm t−¬ng ®−¬ng.
Ph¶n øng chuÈn ®é:
Ag+ + CNS− AgCNS ↓tr¾ng víi TAgCNS = 10−12
NhËn ra t−¬ng ®−¬ng:
Fe3+ + CNS− FeCNS2+ ®á víi β = 102
§iÒu kiÖn ¸p dông:
−
Nång ®é chØ thÞ th−êng dïng sao cho [Fe3+] ≈ 10-2M
−
M«i tr−êng nªn dïng m«i tr−êng acid m¹nh (th−êng dïng HNO3) ®Ó
tr¸nh ↓Fe(OH)3, ↓Ag2O vµ lµm gi¶m hiÖn t−îng hÊp phô.
øng dông:
−
§Þnh l−îng trùc tiÕp Ag+ víi CNS-
−
§Þnh l−îng gi¸n tiÕp (theo ph−¬ng ph¸p thõa trõ) Cl-, Br-, I- b»ng c¸ch
cho d− chÝnh x¸c Ag+ ph¶n øng víi X- (Cl-, Br-, I-) cÇn x¸c ®Þnh
Ag+ + X- AgX↓
(d− chÝnh x¸c)
Sau ®ã ®Þnh l−îng Ag+ b»ng CNS- ®· biÕt nång ®é theo kü thuËt trùc
tiÕp nªu trªn.
191

Chó ý:
−
Khi ®Þnh l−îng Cl- cã hiÖn t−îng mµu chuyÓn kh«ng râ rµng, mµu
kh«ng bÒn, khi mµu bÒn v÷ng th× qu¸ ®iÓm t−¬ng ®−¬ng nhiÒu g©y sai
sè lín. Lý do v× TAgCl = 10-10 > TAgCNS = 10-12 nghÜa lµ ↓ AgCNS bÒn v÷ng
h¬n nªn cã ph¶n øng:
AgCl↓ + CNS- AgCNS↓ + Cl-
x¶y ra do ®ã lµm chuyÓn dÞch c©n b»ng ph©n ly cña phøc vÒ phÝa ph¶i:
FeCNS2+ Fe3+ + CNS-
lµm mÊt mµu ®á.
§Ó kh¾c phôc sai sè nµy ta ph¶i lo¹i bá kÕt tña AgCl, råi sau ®ã míi
®Þnh l−îng Ag+ d− ë phÇn n−íc läc. HoÆc cho thªm vµo hÖ mét dung m«i
h÷u c¬ kh«ng trén lÉn víi n−íc (nh− benzen, ether, cloroform,…) ®Ó lµm
vãn kÕt tña AgCl trªn bÒ mÆt ph©n c¸ch gi÷a 2 líp n−íc - dung m«i h÷u c¬
vµ do ®ã ng¨n kh«ng cho kÕt tña AgCl t¸c dông víi CNS-.
−
Khi ®Þnh l−îng I- kh«ng ®−îc cho chØ thÞ Fe3+ vµo dung dÞch ®Þnh
l−îng tr−íc khi cho Ag+ d− (®Ó tr¸nh ph¶n øng Fe3+ + I- → Fe2+ + I2
x¶y ra).
c. Ph−¬ng ph¸p Faian (Fajans):
Lµ ph−¬ng ph¸p dïng chØ thÞ hÊp phô.
Dùa trªn c¬ së mét sè kÕt tña cã kh¶ n¨ng hÊp thô trªn bÒ mÆt tña
mét sè chÊt h÷u c¬, lµm cho chÊt h÷u c¬ thay ®æi cÊu t¹o vµ cã sù ®æi mµu
râ rÖt (th−êng cã mµu thÉm h¬n).
ThÝ dô: Dïng eozin lµ mét acid h÷u c¬ (HE H+ + E−) lµm chÊt
chØ thÞ khi ®Þnh l−îng I− b»ng Ag+. §Æc tÝnh cña eozin lµ khi E- ë trong
dung dÞch cã mµu hång, nh−ng khi bÞ hÊp thô cã mµu tÝm.
Ph¶n øng chuÈn ®é:
Ag+ + I- = AgI↓
NhËn ra ®iÓm t−¬ng ®−¬ng khi trªn bÒ mÆt tña xuÊt hiÖn mµu tÝm.
Së dÜ nh− vËy v× tr−íc ®iÓm t−¬ng ®−¬ng, dung dÞch d− I- do ®ã AgI↓
hÊp phô I- (kh«ng hÊp thô E- nªn vÉn cã mµu hång). Sau t−¬ng ®−¬ng d−
Ag+ th× AgI↓ hÊp phô Ag+ (lµ ion + nªn cã kh¶ n¨ng hÊp thô thªm E- lµm
cho bÒ mÆt tña cã mµu tÝm)
§iÒu kiÖn dïng:
−
Cè g¾ng gi÷ tña ë tr¹ng th¸i keo (cho nªn cã tr−êng hîp cho thªm chÊt
b¶o vÖ keo nh− tinh bét, dextrin…)
192



![Đề cương ôn tập Hóa phân tích [năm] chi tiết, chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250629/sonvu86/135x160/6131751251868.jpg)



















![Bài giảng Hình học họa hình: Bài mở đầu - Giới thiệu [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250823/kimphuong1001/135x160/99131755935505.jpg)


