
CHƯ Ơ NG 5
H Ó A H Ọ C HEM OGLO BIN
M Ụ C T IÊ U
1. MÔ tả cấ u tạ o hóa họ c và nêu cách phân loạ i, tính chấ t củ a hợ p chấ t Porphyrin.
2. Mô tả cấ u trúc hóa họ c củ a Hem và Globin.
3. Trình bày, giả i thích sự kế t hợ p giữ a Hem và Globin.
5. Nêu đư ợ c tính chấ t hóa họ c và các vai trò sinh lý quan trọ ng củ a Hemoglobin trong cơ
1. ĐẠ I CƯ Ơ NG
1.1 Cromoprotein
Cromoprotein là mộ t loạ i protein phứ c tạ p có nhóm ngoạ i là chấ t màu.
Cromoprotein đư ợ c chia thành hai loạ i :
- Cromoprotein vớ i nhóm ngoạ i không chứ a nhân Porphyrin.
Thí dụ :
Flavoproteiir. nhóm ngoạ i chứ a Riboflavin
Feritin : nhóm ngoạ i chứ a Fe
Hemocyamirr. nhóm ngoạ i chứ a Cu
- Cromoprotein vớ i nhóm ngoạ i chứ a nhân Porphyrin (Porphyrinoprotein)
Thí dụ :
Hemoglobin: sắ c tô" đỏ củ a hồ ng cầ u.
M yoglobin: sắ c tô" hô hấ p chứ a trong tế bào cơ củ a độ ng vậ t.
Clorophyl: diệ p lụ c tô" trong thự c vậ t, đóng vai trò quan trọ ng trong sự quang hợ p.
Cytocrom: enzym vậ n chuyể n điệ n tử trong các phả n ứ ng oxy hóa khử củ a chuỗ i hô hâp tế
bào.
Cãtalase: enzym tham gia các phả n ứ ng oxy hóa khử sinh họ c.
1.2 Porphyrin
1.2.1 Cấ u tạ o hóa họ c
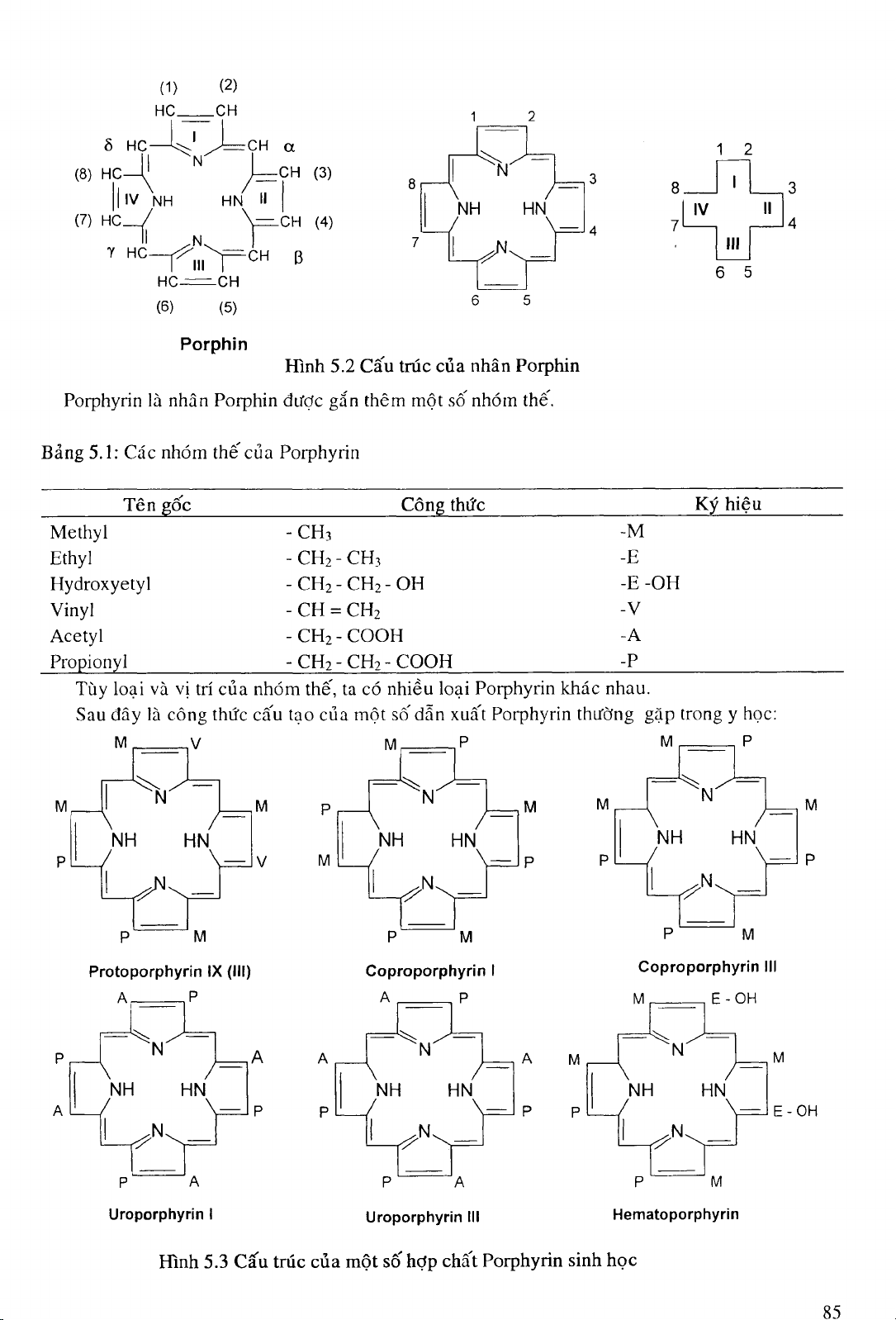
Porphyrin có nhân cơ bả n là Porphin, cấ u tạ o bở i 4 vòng pyrol (dị vòng 5 cạ nh) liên kêt vớ i
nhau qua 4 cầ u nố ì methylen (- CH=).
Trong phân tử porphin :
- Các vòng pyrol đư ợ c đánh sô" I, II, III và IV theo chiề u kim đồ ng hồ .
- Các cầ u methyỉ en đư ợ c ký hiệ u oc, p, y, ô .
- Vị trí củ a các nhóm thế trên khung phân tử đư ợ c đánh sô" 1, 2, 3, 4, 5, 6, 7 và 8.
C H
---------
CH
CH CH \ /
N H N H
Hình 5.1: c ấ u trúc củ a vòng Pyrol
K4
(1)
HC _
5 H C-
(8) H C -
|| IV N H
(7) H C .
(2)
.C H
J = r C H a
: C H (3)
H N II
-N ,
y H C — ^
H C - = ^ C H
(6) (5 )
Porphin
-C H (4 )
-C H ß
1 2
IV II
III
6 5
Hình 5.2 Cấ u trúc củ a nhân Porphin
Porphyrin là nhân Porphin đư ợ c gắ n thêm mộ t số nhóm thế .
Bả ng 5.1: Các nhóm thế củ a Porphyrin
Tên gố c Công thứ c Ký hiệ u
Methyl - c h 3-M
Ethyl - CH2 - c h 3-E
Hydroxyetyl -C H 2-C H 2-OH -E -OH
Vinyl - CH = CH2-V
Acetyl - CH2 - COOH -A
Propionyỉ - CH2 - CH2 - COOH -p
Tùy loạ i và vị trí củ a nhóm thế , ta có nhiề u loạ i Porphyrin khác nhau.
Sau đây là công thứ c cấ u tạ o củ a mộ t sô" dẫ n xuấ t Porphyrin thư ờ ng gặ p trong y họ c:
V
- - - -
NM DN
\//
NH HN NH HN
/\V M /\
M
P ro to p o rp h y rin IX (III)
A ,
_______
.p
M
p M
C o p ro p o rp h y rin I C o p ro p o rp h y rin
N'
NH /
/HN
N.
p A
U rop orphyrin I
A
M
Hình 5.3 Câu trúc củ a m ộ t số hợ p chấ t Porphyrin sinh họ c
85

1.2.2. Tính chấ t
- Có màu, có phổ hấ p thu đặ c trư ng ở vùng tử ngoạ i hay khả kiế n (do có hệ thố ng nôi đôi tiêp
cách).
- Độ tan phụ thuộ c sô" lư ợ ng nhóm carboxyl thế . Ví dụ :
Uroporphyrin có 8 nhóm carboxyl nên tan rấ t tố t trong nư ớ c
Protoporphyrin chỉ có 2 nhóm carboxyl nên ít tan trong nư ớ c, tan nhiề u trong lipid.
- Dễ tạ o phứ c vớ i ion kim loạ i (nhờ hai nguyên tử H gắ n vớ i hai nguyên tử N thuộ c nhân
pyrol II và IV rấ t linh độ ng và dễ bị thay thế bở i các ion kim loạ i có hóa trị 2), do đó protein
nhóm này đư ợ c gọ i là Metaloprotein.
Thí dụ :
Trong Hemoglobin, Myoglobin, Cytocrom, Catalase: Porphyrin kế t hợ p vớ i Fe2+.
Trong Chlorophyll Porphyrin kế t hợ p vớ i Mg2+.
- Có tính kiề m yế u (do nguyên tử N trong các nhân pyrol) đồ ng thờ i cũng có tính acid (do
nhóm -COOH ở mạ ch nhánh). Điể m đẵ ng điệ n khoả ng 3 - 4,5.
2. HEMOGLOBIN (Hb)
Hemoglobin ký hiệ u là Hb, còn gọ i huyế t sắ c tố hay huyế t cầ u tố , là mộ t Cromoprotein thuộ c
nhóm Porphyrinoprotein có màu đỏ , hiệ n diệ n trong hồ ng cầ u củ a các độ ng vậ t cao câp, đóng
nhiề u vai trò sinh lý quan trọ ng trong cơ thể .
Hemoglobin kế t tinh dư ớ i dạ ng nhữ ng tinh thể khác nhau tùy theo mỗ i loài độ ng vậ t.
Hồ ng cầ u ngư ờ i chứ a khoả ng 32% Hemoglobin, tư ơ ng ứ ng vớ i 15g trong 100 ml máu.
2.1. Cấ u tạ o hóa họ c
Hemoglobin gồ m có hai phầ n:
- Protein thuầ n: Globin
- Nhóm ngoạ i: Hem.
2.1.1. Hem
Hem là hợ p chấ t gồ m có nhân Protoporphyrin IX gắ n vớ i sắ t hóa trị II (Fe2+).
Fe2+ nằ m ở trung tâm nôi vớ i 4 nguyên tử N củ a bố n vòng pyrol qua 4 liên kêt nằ m trên mặ t
phẳ ng củ a vòng Porphyrin (trong đó có 2 liên kế t cộ ng hóa trị và 2 liên kêt phôi trí).
Fe còn 2 liên kế t phôi trí nằ m ở vị trí thẳ ng góc vớ i mặ t phẳ ng phân tử , mỗ i liên kêt ở về mộ t
phía. Các liên kế t này có thể kế t hợ p vớ i chuỗ i polypeptid củ a Globin và mộ t số chât khác (Ơ 2,
CO).
Hình 5.4 Câu trúc hóa họ c củ a Hem
86

Hem bị oxy hóa thành Hematin, khi đó Fe2+ biế n thành Fe3+. Hematin có thể đư ợ c tách
riêng dư ớ i dạ ng muôi clorhydrat, thư ờ ng kế t tinh dư ớ i dạ ng các tinh thể đặ c biệ t gọ i là tinh thể
Hemin hay Teichman (đư ợ c ứ ng dụ ng trong pháp y để xác đị nh các vế t máu).
= N N — = N N -
' ' / ' '
F e - O H F e - C l
— N ' n— — N ' n-
Hematin Hemin
Hình 5.5 Dạ ng oxy hóa củ a Hem
2.1.2. Globin
ở ngư ờ i trư ở ng thành, Globin củ a HbA gồ m 4 chuỗ i polypeptid có cấ u trúc bậ c I đã đư ợ c xác
đị nh:
- hai chuỗ i a mỗ i chuỗ i có 141 acid amin
- hai chuỗ i Ị 3, mỗ i chuỗ i có 146 acid amin.
Các chuỗ i này gắ n vớ i nhau bằ ng tư ơ ng tác không cộ ng hóa trị tạ o thành hai dimer (ot|3)i và
(ccp)2
Trong cấ u trúc bậ c II , 80% acid amin củ a các chuỗ i a và p tạ o nên 7 đoạ n xoắ n a helix
(chuỗ i a) hay 8 đoạ n xoắ n a helix (chuỗ i P) . Mỗ i đoạ n xoắ n có chiề u dài từ 7 đế n 20 acid amin,
đư ợ c ký hiệ u A, B, c
.....
theo thứ tự (đoạ n xoắ n a đầ u tiên là A, đoạ n xoắ n a thứ hai là B
.....
và đoạ n xoắ n a thứ 8 là H). Nhữ ng đoạ n acid amin còn lạ i không xoắ n, nằ m giữ a nố i các
đoạ n xoắ n , đư ợ c ký hiệ u bở i hai mẫ u tự củ a hai đoạ n xoắ n ở hai bên. (ví dụ : ở giữ a đoạ n xoắ n
A và đoạ n xoắ n B là đoạ n AB không xoắ n)
Trong cấ u trúc bậ c I II, các chuỗ i a và p cuộ n khúc tạ i các đoạ n acid amin không xoắ n.
Mỗ i chuỗ i polypeptid xoắ n và cuộ n khúc kế t hợ p vớ i mộ t Hem tạ o thành mộ t tiể u đơ n vị củ a
Hb. Bố n tiể u đơ n vị này kế t hợ p vớ i nhau tạ o thành mộ t phân tử Hb có cấ u trúc bậ c bôn
(Tetramer).
về mặ t không gian, chuỗ i Globin cuộ n lạ i tạ o thành mộ t khe kỵ nư ớ c chứ a Hem. Đây chính
là vị trí kế t hợ p vớ i oxy.
Hình 5.6: Các chuỗ i polypeptid củ a Globin
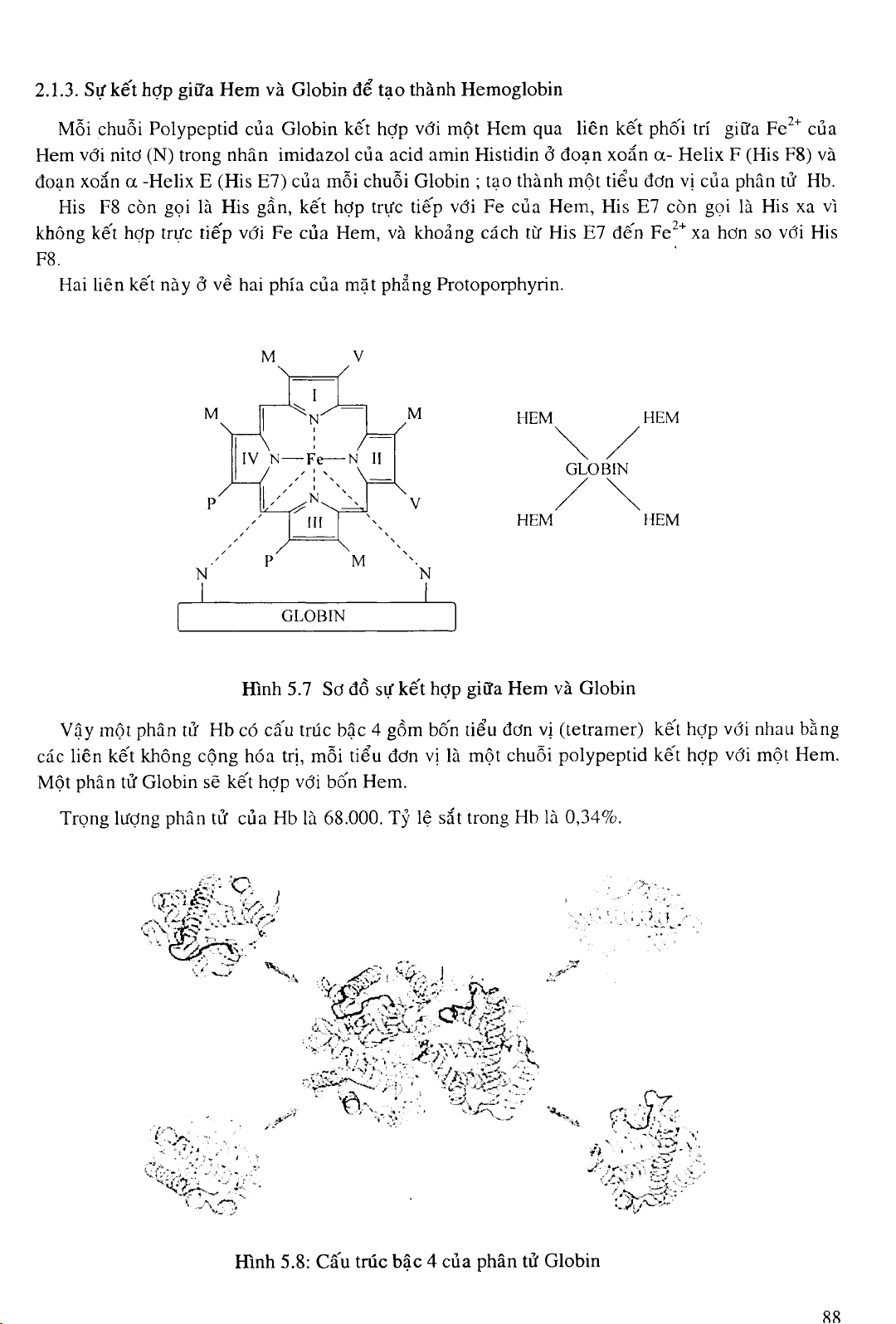
2.1.3. Sự kế t hợ p giữ a Hem và Globin để tạ o thành Hemoglobin
Mỗ i chuỗ i Polypeptid củ a Globin kế t hợ p vớ i mộ t Hem qua liên kế t phôi trí giữ a Fe2+ củ a
Hem vớ i nitơ (N) trong nhân imidazol củ a acid amin Histidin ở đoạ n xoắ n a- Helix F (His F8) và
đoạ n xoắ n a -Helix E (His E7) củ a mỗ i chuỗ i Globin ; tạ o thành mộ t tiể u đơ n vị củ a phân tử Hb.
His F8 còn gọ i là His gầ n, kế t hợ p trự c tiế p vớ i Fe củ a Hem, His E7 còn gọ i là His xa vì
không kế t hợ p trự c tiế p vớ i Fe củ a Hem, và khoả ng cách từ His E7 đế n Fe2+ xa hơ n so vớ i His
F8.
Hai liên kế t này ở về hai phía củ a mặ t phẳ ng Protoporphyrin.
MV
MN'
\ ỉ /
IV N— Fe— N11
/ / ! \ \
N
I I I
M
V
N
M
H E M H E M
G L O B I N
H E M H E M
N
G L O B IN
Hình 5.7 Sơ đồ sự kế t hợ p giữ a Hem và Globin
Vậ y mộ t phân tử Hb có cấ u trúc bậ c 4 gồ m bôn tiể u đơ n vị (tetramer) kêt hợ p vớ i nhau bằ ng
các liên kế t không cộ ng hóa trị , mỗ i tiể u đơ n vị là mộ t chuỗ i polypeptid kêt hợ p vớ i mộ t Hem.
Mộ t phân tử Globin sẽ kế t hợ p vớ i bố n Hem.
Trọ ng lư ợ ng phân tử củ a Hb là 68.000. Tỷ lệ sắ t trong Hb là 0,34%.
ậ‘ ,A
Hình 5.8: c ấ u trúc bậ c 4 củ a phân tử Globin












![Giáo trình Vi sinh vật học môi trường Phần 1: [Thêm thông tin chi tiết nếu có để tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251015/khanhchi0906/135x160/45461768548101.jpg)





![Bài giảng Sinh học đại cương: Sinh thái học [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/oursky02/135x160/99371768295754.jpg)



![Đề cương ôn tập cuối kì môn Sinh học tế bào [Năm học mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260106/hoang52006/135x160/1251767755234.jpg)

![Cẩm Nang An Toàn Sinh Học Phòng Xét Nghiệm (Ấn Bản 4) [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251225/tangtuy08/135x160/61761766722917.jpg)

