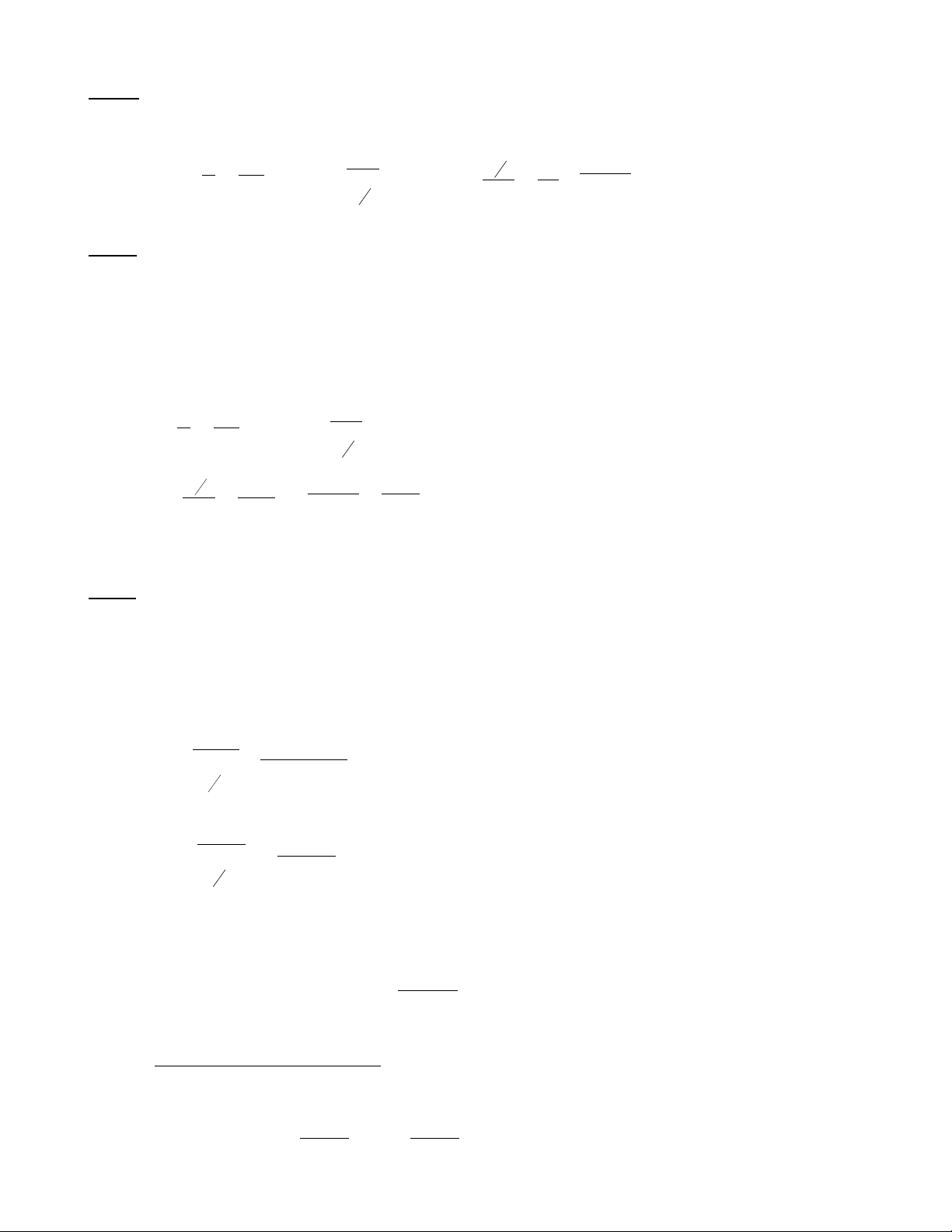BÀI TẬP ĐỘI TUYỂN MÁY TÍNH BỎ TÚI
Phần 1: Động hoá học
Bài 1: Ở 3260C , Buta-1,3-đien đime hoá theo phương trình:
2C4H6 (k) → C8H12(k)
Trong một thí nghiệm, áp suất ban đầu của C4H6 là 632 torr ở 3260C. Xác định bậc của
phản ứng và hằng số tốc độ của phản ứng đó theo số liệu sau:
t(ph) 0 3,25 12,18 24,55 42,5 68,05
P(torr) 632 618,5 584,2 546,8 509,3 474,6
ĐS: Phản ứng bậc 2
K = 2,306.10-5 (phút-1.torr-1)
Bài 2: Sự phân huỷ etan ở nhiệt độ cao xảy ra theo phương trình:
C2H6 → C2H4 + H2
Và tuân theo phương trình động học một chiều bậc nhất
1) Tại 5070C, 11/2 = 3000 (s). Khi C2H6 phân huỷ hết Phệ = 1000 mmHg. Tính kp và
P0C2H6 ?
2) Nhiệt độ phản ứng tăng thêm 200C , tốc độ phản ứng tăng gấp đôi. Tính t1/2 của phản
ứng ở nhiệt độ này và E0a của phản ứng.
ĐS: 1) kP = 2,31.10-4 (s-1) ; P0 = 500 (mmHg)
2) t1/2 = 1500 s; E0a = 179,8 (kJ/mol)
Bài 3: Sự thuỷ phân 1 este trong môi trường kiềm ở 250C xảy ra theo phương trình phản
ứng:
RCOO R’ + NaOH → RCOONa + R’OH
thực nghiệm cho thấy tốc độ phản ứng tăng gấp đôi khi nồng độ NaOH tăng 2 lần. Đối với
sự tăng gấp đôi nồng độ este cũng thu được kết quả như vậy.
a) Cho biết bậc riêng phần đối với mỗi chất và bậc toàn phần của phản ứng
b) Tan 0,01 mol xút và 0,01 mol este vào 1 lit nước (bỏ qua sự biến thiên thể tích khi
pha chế) Sau 200 phút có 60% este bị thuỷ phân. Tính k, t1/2, E0a của phản ứng. Biết
hệ số nhiệt độ của phản ứng
ĐS: a) phản ứng bậc 2
b) k = 0,75 l.mol-1. phút-1
t1/2 = 133,33 phút
E0a = 1,2128 (kJ/mol)
Bài 4: Phản ứng phân huỷ axeton ở 3000C xảy ra theo sơ đồ
CH3COCH3 → CH4 + CO + H2
Nồng độ CH3COCH3 thay đổi theo thời gian như sau
t(phút) 0 6,5 13,0 19,9
C (M) 8,31 7,04 5,97 4,93
1) Hãy chứng tỏ đó là phản ứng bậc nhất, tính hằng số tốc độ của phản ứng
2) Tính thời gian nửa phản ứng
3) Ở 3430C hằng số tốc độ phản ứng bằng 2,15 phút-1. Hãy tính hệ số nhiệt độ và năng
lượng hoạt hoá của phản ứng. Cho biết ý nghĩa của năng lượng hoạt hoá đó
ĐS: k = 0,0257 phút-1
t1/2 = 26,96 phút
hệ số nhiệt độ: 2,8 ; Ea0 = 302,1065 kJ/mol