
TNU Journal of Science and Technology
230(05): 11 - 18
http://jst.tnu.edu.vn 11 Email: jst@tnu.edu.vn
ASSESSMENT OF ANTAGONISTIC ACTIVITY AGAINST Proteus mirabilis
CAUSING SOFT ROT DISEASE ON GREEN ONION (Allium fistulosum) OF Bacillus spp.
Nguyen Thi Lien*, Phan Ngoc Nhu Ngoc, Ngo Thi Huynh My,
Le Tuan Tuong, Nguyen Thanh Thao, Nguyen Tang Phu
Institute of Food and Biotechnology – Can Tho University
ARTICLE INFO
ABSTRACT
Received:
01/10/2024
Bacterial soft rot can cause serious damage in various crops. Bacillus
spp. had been reported as effective biological control agents in
controlling many phytopathogens. This study aimed to isolate and
select Bacillus spp. strains from green onion (Allium fistulosum)
rhizosphere soil with antagonistic activity against Proteus mirabilis
SSR (strain SSR) causing. A total of 25/45 Bacillus isolates showed
antagonistic activity against SSR strain in co-culture test in liquid
medium. Most of the antagonistic bacterial isolates were capable of
producing siderophore. Regarding the ability to produce hydrolytic
enzymes, the number of isolates capable of producing protease and
esterase were 15 and 7, respectively. The potential antagonistic isolate
DT2 was identified as Bacillus thuringiensis through the results of 16S
rRNA gene sequencing and biochemical characteristics. This study
indicated the potential of Bacillus spp. in controlling soft rot of green
onion caused by P. mirabilis.
Revised:
17/12/2024
Published:
18/12/2024
KEYWORDS
Antagonistic ability
Green onion
Proteus mirabilis
Rhizobacteria
Soft rot
ĐÁNH GIÁ KHẢ NĂNG ĐỐI KHÁNG Proteus mirabilis GÂY THỐI NHŨN
HÀNH LÁ (Allium fistulosum) CỦA Bacillus spp.
Nguyễn Thị Liên*, Phan Ngọc Như Ngọc, Ngô Thị Huỳnh My,
Lê Tuấn Tường, Nguyễn Thanh Thảo, Nguyễn Tăng Phú
Viện Công nghệ sinh học và Thực phẩm – ĐH Cần Thơ
THÔNG TIN BÀI BÁO
TÓM TẮT
Ngày nhận bài:
01/10/2024
Thối nhũn do vi khuẩn là một bệnh gây thiệt hại nghiêm trọng ở nhiều
loại cây trồng khác nhau. Bacillus spp. được báo cáo là tác nhân kiểm
soát sinh học hiệu quả trong kiểm soát nhiều mầm bệnh gây hại cây
trồng. Nghiên cứu này được thực hiện với mục tiêu phân lập và tuyển
chọn được các chủng vi khuẩn Bacillus spp. từ đất vùng rễ hành lá
(Allium fistulosum) với hoạt tính đối kháng Proteus mirabilis SSR
(chủng SSR) gây bệnh thối nhũn. Tổng số 25/45 chủng Bacillus phân
lập cho thấy hoạt tính đối kháng chủng SSR trong thử nghiệm đồng
nuôi cấy trong môi trường lỏng. Hầu hết các chủng vi khuẩn thể hiện
khả năng đối kháng đều có khả năng sinh ra siderophore. Đối với khả
năng sản sinh enzyme ly giải, số chủng vi khuẩn thử nghiệm có khả
năng sinh protease và esterase lần lượt là 15 và 7. Chủng vi khuẩn
DT2 được xác định là Bacillus thuringiensis thông qua kết quả giải
trình tự vùng gen 16S rRNA và các đặc điểm sinh hoá. Kết quả nghiên
cứu cho thấy tiềm năng của Bacillus spp. trong phòng trừ vi khuẩn P.
mirabilis gây thối nhũn hành lá.
Ngày hoàn thiện:
17/12/2024
Ngày đăng:
18/12/2024
TỪ KHÓA
Hành lá
Khả năng đối kháng
Proteus mirabilis
Thối nhũn
Vi khuẩn vùng rễ
DOI: https://doi.org/10.34238/tnu-jst.11214
* Corresponding author. Email: ntlien@ctu.edu.vn

TNU Journal of Science and Technology
230(05): 11 - 18
http://jst.tnu.edu.vn 12 Email: jst@tnu.edu.vn
1. Giới thiệu
Hành lá được trồng phổ biến ở Việt Nam và thường được dùng như một loại rau gia vị. Hành
lá có giá trị dinh dưỡng cao và đem lại hiệu quả kinh tế cho người nông dân [1]. Hành lá có thể
được tiêu thụ trong nước và đặc biệt có tiềm năng xuất khẩu [1]. Tuy nhiên, trong quá trình canh
tác cây hành thường bị tấn công bởi nhiều mầm bệnh khác nhau. Bệnh thối ướt do vi khuẩn gây ra
nhiều thiệt hại lớn trong quá trình canh tác và bảo quản sau thu hoạch các loại hành khác nhau. Các
vi khuẩn là tác nhân gây thối ướt hành được ghi nhận thuộc các chi/loài như Pectobacterium spp.
(còn được gọi là Erwinia spp.) [2], Burkholderia spp. [2], Pseudomonas aeruginosa [3] và họ vi
khuẩn Enterobacteriaceae [4]. Thuốc hoá học đóng vai trò quan trọng trong kiểm soát bệnh hại
thực vật [5]. Tuy nhiên, với tình hình biến đổi khí hậu ngày càng gia tăng và sự phụ thuộc quá mức
vào thuốc hoá học đã dẫn đến tình trạng kháng thuốc ở nhiều mầm bệnh [5]. Vi khuẩn vùng rễ kích
thích sinh trưởng cây trồng (plant growth promoting rhizobacteria – PGPR) giúp tối ưu sự hấp thu
dinh dưỡng của cây, tăng cường sức chống chịu với các điều kiện môi trường khắc nghiệt [6]. Đồng
thời, PGPR có thể hoạt động như tác nhân kiểm soát sinh học giúp cây chống lại sự tấn công của
các mầm bệnh thông qua các cơ chế trực tiếp (như sản sinh các hợp chất kháng sinh, enzyme thuỷ
phân) hoặc qua cơ chế gián tiếp (kích thích tính kháng bệnh ở cây trồng) [6]. Nhiều loài thuộc chi
Bacillus được ghi nhận về khả năng sản sinh nhiều hợp chất kháng khuẩn như peptide kháng sinh,
lipopeptide, bacteriocin với phổ ức chế rộng giúp kiểm soát nhiều mầm bệnh [7]. Hoạt tính kháng
khuẩn của Bacillus spp. đã được báo cáo trong nhiều nghiên cứu giúp chống lại các vi khuẩn gây
bệnh ở cây trồng như Ralstonia solanacearum [8], Xanthomonas campestris pv. campestris [9],
Pectobacterium caratovum [10]. Nghiên cứu này được thực hiện với mục tiêu phân lập và tuyển
chọn được các chủng Bacillus spp. có khả năng đối kháng với vi khuẩn Proteus mirabilis gây thối
ướt hành lá. Các chủng vi khuẩn tiềm năng có thể sử dụng như vật liệu cho các nghiên cứu phòng
trừ bệnh thối nhũn hành lá trong điều kiện thực tế.
2. Phương pháp nghiên cứu
2.1. Vật liệu nghiên cứu
Chủng vi khuẩn Proteus mirabilis SSR được phân lập từ mẫu hành lá biểu hiện triệu chứng thối
ướt. Chủng vi khuẩn SSR cho thấy triệu chứng bệnh thối ướt trên cây hành lá khi tiến hành xử lý
chủng bệnh nhân tạo. Chủng vi khuẩn SSR được lưu trữ tại phòng thí nghiệm Vi sinh, Viện Công
nghệ sinh học và Thực phẩm, Trường Đại học Cần Thơ.
2.2. Phân lập vi khuẩn và khảo sát khả năng đối kháng với chủng SSR
2.2.1. Phân lập vi khuẩn từ mẫu đất vùng rễ
Thu thập mẫu đất: Mẫu đất vùng rễ hành lá được thu thập tại các ruộng trồng hành tại An Giang,
Cần Thơ, Đồng Tháp, Hậu Giang, Vĩnh Long. Tại các ruộng hành, các vị trí cây hành phát triển khoẻ
mạnh, không biểu hiện triệu chứng bệnh được chọn để thu mẫu đất. Tại vị trí thu mẫu, dùng dao nhỏ
xới quanh bụi hành và nhổ lấy cây hành với phần rễ có đất bao quanh. Phần rễ cây hành được cho
vào các túi nylon vô trùng, ghi nhận thông tin và vận chuyển nhanh chóng về phòng thí nghiệm.
Phân lập vi khuẩn: Các cây hành thu thập được lắc nhẹ để đất rơi khỏi gốc hành. Các mẫu đất
thu thập (10 g) được cho vào 90 mL dung dịch NaCl 0,85% vô trùng, khuấy đều và để lắng ở nhiệt
độ phòng trong 15 phút. Phần dịch trong sau lắng (2 mL) được ủ ở nhiệt độ 80°C trong 10 phút
trên máy ủ nhiệt, sau đó để nguội [11]. Các mẫu sau khi xử lý nhiệt được pha loãng đến nồng độ
10-4 bằng dung dịch NaCl 0,85% vô trùng. Các nồng độ pha loãng (100 µL) được trải lên các đĩa
Petri chứa môi trường Luria Bertani agar (LB agar) (g/L: tryptone 10; cao chiết nấm men 5; NaCl
10; agar 15). Sau 72 giờ ủ ở 30°C, các khuẩn lạc có đặc điểm khác nhau được chọn và cấy chuyển
nhiều lần trên môi trường LB agar đến khi các khuẩn lạc phát triển có đặc điểm đồng nhất. Các
chủng vi khuẩn phân lập được nhuộm Gram, nhuộm bào tử, thử nghiệm catalase. Theo mô tả của

TNU Journal of Science and Technology
230(05): 11 - 18
http://jst.tnu.edu.vn 13 Email: jst@tnu.edu.vn
Holt [12] vi khuẩn Bacillus có tế bào hình que, Gram dương, có khả năng sản sinh nội bào tử,
catalase dương tính, kỵ khí tuỳ nghi.
2.2.2. Khảo sát khả năng đối kháng với chủng SSR của các chủng Bacillus spp. phân lập
Chuẩn bị huyền phù vi khuẩn SSR và vi khuẩn Bacillus spp.: Các chủng vi khuẩn khảo sát được
nuôi cấy trên môi trường LB agar trong 24 giờ. Dùng kim cấy đầu tròn lấy một vòng đầy sinh khối
của vi khuẩn chuyển vào ống nghiệm thủy tinh có nắp chứa sẵn 10 mL dung dịch NaCl 0,85% vô
trùng. Dịch huyền phù các chủng vi khuẩn thử nghiệm được điều chỉnh về giá trị độ truyền quang
ở bước sóng 600 nm (OD600) bằng 0,1.
Khảo sát khả năng đối kháng: Huyền phù vi khuẩn SSR (50 µL) và huyền phù vi khuẩn Bacillus
(50 µL) được thêm vào các falcon chứa 10 mL môi trường LB lỏng. Đối chứng được bố trí với
huyền phù vi khuẩn SSR (50 µL) và 5 mL môi trường LB lỏng. Mỗi nghiệm thức lặp lại 3 lần
tương ứng với 3 ống. Các ống được ủ ở nhiệt độ phòng trong 24 giờ trên máy lắc với tốc độ 120
rpm. Sau đó, mật số vi khuẩn SSR ở các nghiệm thức được xác định bằng phương pháp nhỏ giọt
mô tả bởi Naghili [13]. Dịch vi khuẩn ở các nghiệm thức khảo sát được pha loãng đến nồng độ 10-
8 với dung dịch NaCl 0,85% vô trùng. Các nồng độ pha loãng (10 µL) được nhỏ giọt lên đĩa môi
trường MacConkey agar nhằm ức chế sự phát triển của vi khuẩn Bacillus [14]. Các đĩa được giữ
cố định đến khi giọt vi khuẩn khô hoàn toàn và ủ ở 30°C trong 17-20 giờ. Các nồng độ pha loãng
có số khuẩn lạc nằm trong khoảng 3-30 khuẩn lạc/giọt được chọn để tính mật số chủng vi khuẩn
SSR trong mẫu ban đầu [13].
Mật số vi khuẩn (CFU/mL) = Trung bình số khuẩn lạc của ít nhất 3 giọt × Hệ số pha loãng của
nồng độ thoả điều kiện × 100 (1)
Hoạt tính đối kháng với chủng SSR của các chủng Bacillus spp. được thể hiện dưới dạng phần
trăm ức chế sự phát triển của chủng SSR.
Phần trăm ức chế sự phát triển của chủng SSR (%) = (𝐷−𝑑
𝐷) × 100 (2)
D: Mật số chủng SSR ở nghiệm thức ủ chung với vi khuẩn Bacillus; d: Mật số chủng SSR ở
nghiệm thức đối chứng.
2.3. Khảo sát khả năng sản sinh protease, lipase và siderophore
2.3.1. Enzyme protease
Huyền phù Bacillus spp. (3 µL) được nhỏ giọt trên môi trường bổ sung sữa gầy (g/L: sữa gầy
28; casein hydrolysate 5; dextrose 1; yeast extract 2,5; agar 20) [15]. Các đĩa được giữ cố định đến
khi khô giọt vi khuẩn, sau đó ủ ở nhiệt độ phòng trong 48 giờ. Sau khi ủ, xung quanh khuẩn lạc
xuất hiện vòng phân giải chỉ ra khả năng sản sinh protease của các chủng vi khuẩn thử nghiệm. Chỉ
số hoạt động enzyme (EI) = Đường kính vùng phân giải/Đường kính khuẩn lạc [16].
2.3.2. Enzyme esterase
Huyền phù Bacillus spp. (3 µL) được nhỏ giọt trên môi trường bổ sung Tween 20 (g/L: peptone
10, NaCl 5; CaCl2.2H2O 0,1; Tween 80 10 mL; agar 20) [17]. Các đĩa được giữ cố định đến khi
khô giọt vi khuẩn và ủ ở nhiệt độ phòng trong 72 giờ. Sau khi ủ, xung quanh khuẩn lạc xuất hiện
các hạt kết tủa cho thấy hoạt động của esterase sinh ra bởi các chủng vi khuẩn thử nghiệm. Chỉ số
hoạt động enzyme (EI) = Đường kính vùng phân giải/Đường kính khuẩn lạc [16].
2.3.3. Siderophore
Huyền phù các chủng Bacillus spp. (100 µL) được thêm vào 10 mL LB lỏng và ủ trên máy lắc
ở 30°C với tốc độ lắc 120 vòng/phút trong 48 giờ. Dịch nuôi cấy các chủng Bacillus spp. thử
nghiệm (2 mL) được tiến hành thu phần dịch nổi bằng cách ly tâm với tốc độ 13000 vòng/phút
trong 10 phút.
Dịch nổi sau ly tâm (1 mL) được trộn đều với 1 mL thuốc thử chrome azurol S (CAS) [18]. Sau
khi ủ ở điều kiện tối trong 20 phút, độ hấp thụ quang của hỗn hợp được xác định ở bước sóng 630

TNU Journal of Science and Technology
230(05): 11 - 18
http://jst.tnu.edu.vn 14 Email: jst@tnu.edu.vn
nm. Khả năng sản sinh siderophore của các chủng Bacillus spp. thử nghiệm được tính toán theo
công thức:
Phần trăm sản sinh siderophore (%) = (Ar−As)×100
Ar (3)
Trong đó:
Ar: độ hấp thụ quang của đối chứng (thuốc thử CAS + LB lỏng)
As: độ hấp thụ quang của hỗn hợp mẫu (thuốc thử CAS + dịch nổi sau ly tâm)
2.4. Định danh chủng vi khuẩn đối kháng
Chủng Bacillus spp. DT2 với hoạt tính đối kháng cao, có khả năng sản sinh protease, esterase
và siderophore được tiến hành giải trình tự vùng 16S rRNA. DNA tổng số của chủng DT2 được ly
trích theo mô tả của Chen và Kuo [19]. Vùng gen 16S rRNA của chủng DT2 được khuếch đại với
cặp mồi 27F (5′-AGAGTTTGATCCTGGCTCAG-3′) và 1492R (5′-GGCTACCTTGTTACGTA-
3′) [20]. Phản ứng PCR được thực hiện với máy MultiGene Optimax Thermal Cycler, với chu kỳ
nhiệt như sau: 5 phút ở 94°C, 35 chu kỳ với 1 phút ở 94°C, 1 phút 58°C, 2 phút ở 72°C và bước
cuối cùng 10 phút ở 72°C. Sản phẩm PCR được kiểm tra bằng cách điện di trên gel agarose 1,5%.
Sản phẩm PCR vùng 16S rRNA của chủng DT2 được gửi đi tinh sạch và giải trình tự tại Công ty
TNHH DNA sequencing. Trình tự vùng gen 16S rRNA của chủng DT2 được sử dụng để xây dựng
cây phân loại sử dụng Neighbor-joining methods với thuật toán Jukes-Cantor model với độ lặp lại
2000 lần với phần mềm Molecular Evolution Genetics Analysis (MEGA) version 6.0.6. Bên cạnh
đó, chủng DT2 được nhuộm với thuốc nhuộm coomassie brilliant blue G-250 theo mô tả của
Ammons [21] để xác định khả năng sản sinh các thể protein độc như tinh thể protein (crystal
protein), thể ký sinh (parasporal body) của loài Bacillus thuringiensis.
2.5. Phương pháp phân tích kết quả
Các số liệu hoạt tính đối kháng, chỉ số hoạt động enzyme và phần trăm sản sinh siderophore
được xử lý bằng phần mềm Microsoft Excel 2019 và phân tích thống kê bằng phương pháp phân
tích phương sai One-way ANOVA với phần mềm Minitab 16.
3. Kết quả và thảo luận
3.1. Kết quả phân lập và khảo sát hoạt tính đối kháng với vi khuẩn P. mirabilis
Tổng số 45 chủng vi khuẩn được phân lập từ 10 mẫu đất vi khuẩn vùng rễ hành lá. Tất cả các
chủng vi khuẩn phân lập đều có tế bào hình que, thuộc nhóm vi khuẩn Gram dương (hình 1a) và
có khả năng sản sinh nội bào tử (hình 1b). Đồng thời các chủng vi khuẩn phân lập phát triển được
ở điều kiện hiếu khí, nên có thể loại trừ khả năng thuộc chi Clostridium (có khả năng sinh bào tử
nhưng chỉ phát triển ở điều kiện kỵ khí bắt buộc). Đặc điểm của các chủng vi khuẩn vùng rễ phân
lập trùng khớp với các mô tả của Holt [12] về chi Bacillus. Vùng rễ hành được ghi nhận có sự hiện
diện của nhiều ngành vi sinh vật khác nhau Elusimicrobiota, Proteobacteria, Actinobacteria,
Firmicutes, Fusobacteriota, Desulfobacterota, Bacteroidota và các nhóm khác [22]. Bacillus thuộc
ngành Firmicutes là một trong những ngành hiện diện phổ biến ở vùng rễ hành.
Hình 1. Kết quả nhận diện đặc điểm của các chủng Bacillus spp. phân lập: (a) Nhuộm Gram, (b) Nhuộm
bào tử (mũi tên đơn: tế bào sinh dưỡng, mũi tên kép: bào tử) và (c) Thử nghiệm catalase
TNU Journal of Science and Technology
230(05): 11 - 18
http://jst.tnu.edu.vn 15 Email: jst@tnu.edu.vn
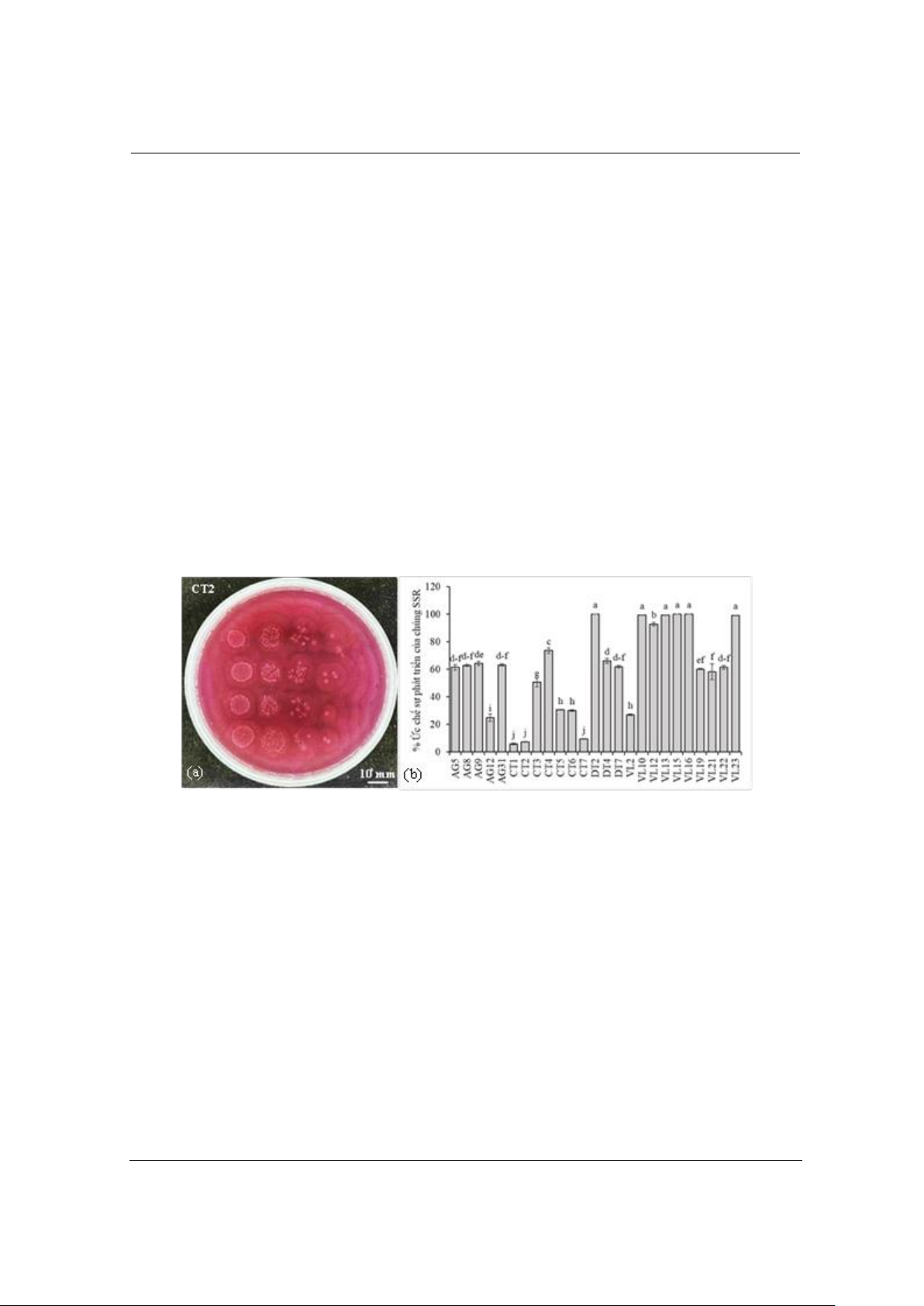
Trong 45 chủng vi khuẩn Bacillus thử nghiệm, 25 chủng vi khuẩn thể hiện hoạt tính kháng khuẩn
với chủng P. mirabilis SSR. Phần trăm ức chế sự phát triển của chủng SSR bởi các chủng Bacillus
spp. có khả năng đối kháng dao động từ 7,36-100%. Sáu chủng vi khuẩn DT2, VL10, VL13, VL15,
VL16, VL23 cho thấy hoạt tính kháng khuẩn cao, với sự khác biệt không có ý nghĩa về mặt thống kê
với nhau (hình 2b). Mật số chủng vi khuẩn SSR ở nghiệm thức đồng nuôi cấy mầm bệnh và Bacillus
đối kháng thấp hơn so với nghiệm thức đối chứng (hình 2a). Cả mầm bệnh và vi khuẩn được cung
cấp một lượng môi trường tương đương nhau, do đó mật số mầm bệnh giảm không do sự thiếu hụt
dinh dưỡng khi đồng nuôi cấy 2 chủng vi khuẩn mà do hoạt tính đối kháng của Bacillus. Hoạt tính
đối kháng của các chủng vi khuẩn Bacillus có thể do khả năng tăng mật số nhanh chóng dẫn đến cạnh
tranh không gian và dinh dưỡng với mầm bệnh, hoặc khả năng sinh ra các enzyme thuỷ phân,
siderophore hay kháng sinh nhằm tiêu diệt/ức chế sự phát triển của mầm bệnh.
Khả năng đối kháng của Bacillus với vi khuẩn gây hại cây trồng đã được báo cáo trong nhiều
nghiên cứu. B. velezensis CE100 có khả năng làm giảm tỷ lệ tăng sinh của Pectobacterium
carotovorum ở giai đoạn sớm và ở thời gian dài hơn vi khuẩn gây bệnh mất khả năng sống sót [10].
Trong một nghiên cứu khác, Bacillus velezensis F18, HC-5, L73 phân lập từ đất vùng rễ gừng cho
thấy khả năng đối kháng mạnh với Ralstonia solanacearum [8]. Các chủng vi khuẩn này mang các
đặc điểm kích thích sinh trưởng cây trồng như hoà tan phosphate, kali, tổng hợp IAA và đối kháng
với mầm bệnh như tổng hợp siderophore, mang gen sinh tổng hợp dipeptide, bacilysin, polyketide
macrolactin, bacillaene, difficidin [8]. Bacillus amyloliquefaciens SS-12.6 và SS38.4 được báo cáo
có khả năng đối kháng với nhiều loài vi khuẩn gây hại trên khoai tây, các cơ chế đối kháng được
xác định chủ yếu do hoạt động của lipopeptide [23].
Hình 2. Kết quả đánh giá khả năng ức chế P. mirabilis của các chủng Bacillus phân lập: (a) Kiểm tra mật
số chủng SSR ở nghiệm thức đồng nuôi cấy với chủng CT2 và (b) Kết quả phần trăm ức chế sự phát triển
của chủng SSR bởi các chủng Bacillus spp.
3.2. Kết quả khảo sát khả năng sản sinh enzyme thuỷ phân và siderophore của các chủng
Bacillus spp. có khả năng đối kháng
Trong số 25 chủng Bacillus thử nghiệm có 13 chủng có khả năng sản sinh protease (hình 3a).
Các chủng DT2, DT4 và VL16 cho thấy chỉ số hoạt động protease cao nhất, khác biệt không có ý
nghĩa thống kê so với nhau (bảng 1). Protease sản sinh bởi Bacillus siamensis CSB55 phân lập từ
kim chi có khả năng thâm nhập vào màng tế bào vi khuẩn và dẫn đến phá vỡ màng tế bào [24].
Màng tế bào đóng vai trò quan trọng trong việc bảo vệ tế bào vi khuẩn, protease sản sinh bởi các
chủng Bacillus đối kháng có thể dẫn đến việc suy yếu tính toàn vẹn của màng tế bào mầm bệnh, từ
đó mầm bệnh bị ức chế.
Khả năng sản sinh esterase được ghi nhận ở 7/25 chủng Bacillus với khả năng đối kháng (hình
3b). Trong đó, chủng AG5 cho kết quả chỉ số hoạt động esterase cao nhất, sự khác biệt có ý nghĩa
thống kê so với các chủng còn lại (bảng 1). Nhóm enzyme thuỷ phân liên kết este như lipase,
esterase có thể tác động đến lipoprotein, lipopolysaccharide và phospholipid bao quanh lớp












![Giáo trình Vi sinh vật học môi trường Phần 1: [Thêm thông tin chi tiết nếu có để tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251015/khanhchi0906/135x160/45461768548101.jpg)





![Bài giảng Sinh học đại cương: Sinh thái học [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/oursky02/135x160/99371768295754.jpg)



![Đề cương ôn tập cuối kì môn Sinh học tế bào [Năm học mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260106/hoang52006/135x160/1251767755234.jpg)

![Cẩm Nang An Toàn Sinh Học Phòng Xét Nghiệm (Ấn Bản 4) [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251225/tangtuy08/135x160/61761766722917.jpg)

