
TRƯỜNG THPT NGUYỄN DU
ĐỀ KIỂM TRA 15 PHÚT( phần amin)
Câu1: Có bao nhiêu đồng phân CTPT C4H11N là amin bậc một?
A,1 ; B,2 ; C,3 ; D,4
Câu2: (CH3)2CHNHCH3 có tên thay thế là:
A,metylisopropylamin ; B,trimetylamin
C,N-metylpropan-2-amin ; C,cả Avà C đều đúng
Câu3:Dãy chất được xếp theo thứ tự tính bazơ tăng dần:
A,NH3,C6H5NH2, CH3NH2, C2H5NH2 ; B,C6H5NH2, NH3, CH3NH2,( CH3)2NH
C,C6H5NH2, NH3 ,( CH3)2NH , CH3NH2; D,C6H5NH2,CH3NH2, NH3 , ( CH3)2NH
Câu4:Amin no đơn chức mạch hở có CTTQ là:
A,CnH2n+2N ; B,CnH2nN ; C,CnH2n+2N ; D,CnH2n+3N
Câu5: Dãy chất nào sau đây,dung dịch của chúng đều làm đổi màu qùy tím thành
xanh:
A,CH3COONa, NH3, C2H5NH2 ; B,NaOH, CH3NH2,C6H5NH2
C,NaOH, NH3,,C6H5NH3Cl ; D,NaOH, CH3NH2,CH3NH3Cl
Câu6: Điều nào sai trong các điều sau:
A,tất cả amin đều có tính bazơ
B,có thể dùng dung dịch brom để nhận biết anilin
C,benzylamin tan vô hạn trong nước và dung dịch làm đổi màu quỳ tím thành xanh
D,bậc của amin bằng bậc cacbon liên kết với N
Câu7:Cho11,8g một amin no X tác dụng hoàn toàn với dung dịch HCl dư thu được
19,1g muối. CTPT của X là:
A,C2H7N; B,C3H7N; C,C3H9N; D,C4H11N
Câu8: Đốt cháy hoàn toàn một amin đơn chức X thu được 8,4 lit CO2(đktc),10,125g

H2O và 1,4lit N2(đktc).CTPT của X là:
A,C2H5N; B,C3H7N; C,C3H9N; D,C4H11N
Câu9: Cho 4,65g anilin phản ứng với dung dịch brôm dư thu được 13,2g kết tủa.%
khối lượng anilin đã phản ứng là:
A,50%; B,60%; C,70%; D,80%
Câu10: Amin X tác dụng với dung dịch HCl tạo muối dạng RNH3Cl, biết %khối
lượng N trong X là 23,73%, tên X là:
A,propan-1-amin; B,propan-2-amin
C,prop-2-en-1-amin; D,cả A,B đều đúng

Trung tâm GDTX Thành Phố Đề kiểm tra 15 phút
Khoanh tròn vào đáp án đúng.
Câu1: Dãy kim loại tác dụng được với nước ở nhiệt độ thường là:
A. Fe, Zn, Li, Sn. C. K, Na, Ca, Ba.
B. Cu, Pb, Rb, Ag. D. Al, Hg, Cs, Sr.
Câu2: Có 5 kim loại là Mg, Ba, Al, Fe, Ag. Nếu chỉ dùng thêm dung dịch H2SO4 loãng thì
có thể nhận biết được các kim loại:
A. Mg, Ba, Ag. C. Mg, Ba, Al, Fe.
B. Mg, Ba, Al. D. Mg, Ba, Al, Fe, Ag.
Câu3: Kim loại khác nhau có độ dẫn điện, dẫn nhiệt khác nhau. Sự khác nhau đó được
quyết định bởi:
A. khối lượng riêng khác nhau. C. mật độ electron tự do khác nhau.
B. kiểu mạng tinh thể khác nhau. D. mật độ ion dương khác nhau.
Câu4: Ngâm một lá kim loại Ni trong những dung dịch muối sau: MgSO4, NaCl, CuSO4,
AlCl3, ZnCl2, Pb(NO3)2, AgNO3. Hãy cho biết muối nào có phản ứng với Ni.
A. CuSO4, Pb(NO3)2, AgNO3. C. MgSO4, NaCl, CuSO4, AlCl3, ZnCl2.
B. MgSO4, NaCl, AlCl3, ZnCl2. D. CuSO4, AlCl3, ZnCl2, Pb(NO3)2, AgNO3.
Câu5: Hoà tan hoàn toàn 20 gam hỗn hợp Fe và Mg trong dung dịch HCl thu được 1 gam
H2. Khi cô cạn dung dịch thu được bao nhiêu gam muối khan?
A. 54,5 C. 56,5
B. 55,5 D. 57,5
1 CTHC
KIỂM TRA 15 PHÚT HÓA HỌC
Câu I (4 điểm): 1. 1,25 điểm ; 2. 1 điểm ; 3. 1,75 điểm
1. 3-metylbuten-1 tác dụng với axit clohidric tạo ra các sản phẩm, trong đó có A là 2-
clo-3-metylbutan và B là 2-clo-2-metylbutan. Bằng cơ chế phản ứng, hãy giải thích sự
tạo thành hai sản phẩm A và B.
2. 2-metylbuten-2 phản ứng với axit clohidric. Trình bày cơ chế của phản ứng, cho biết
sản phẩm chính và giải thích?
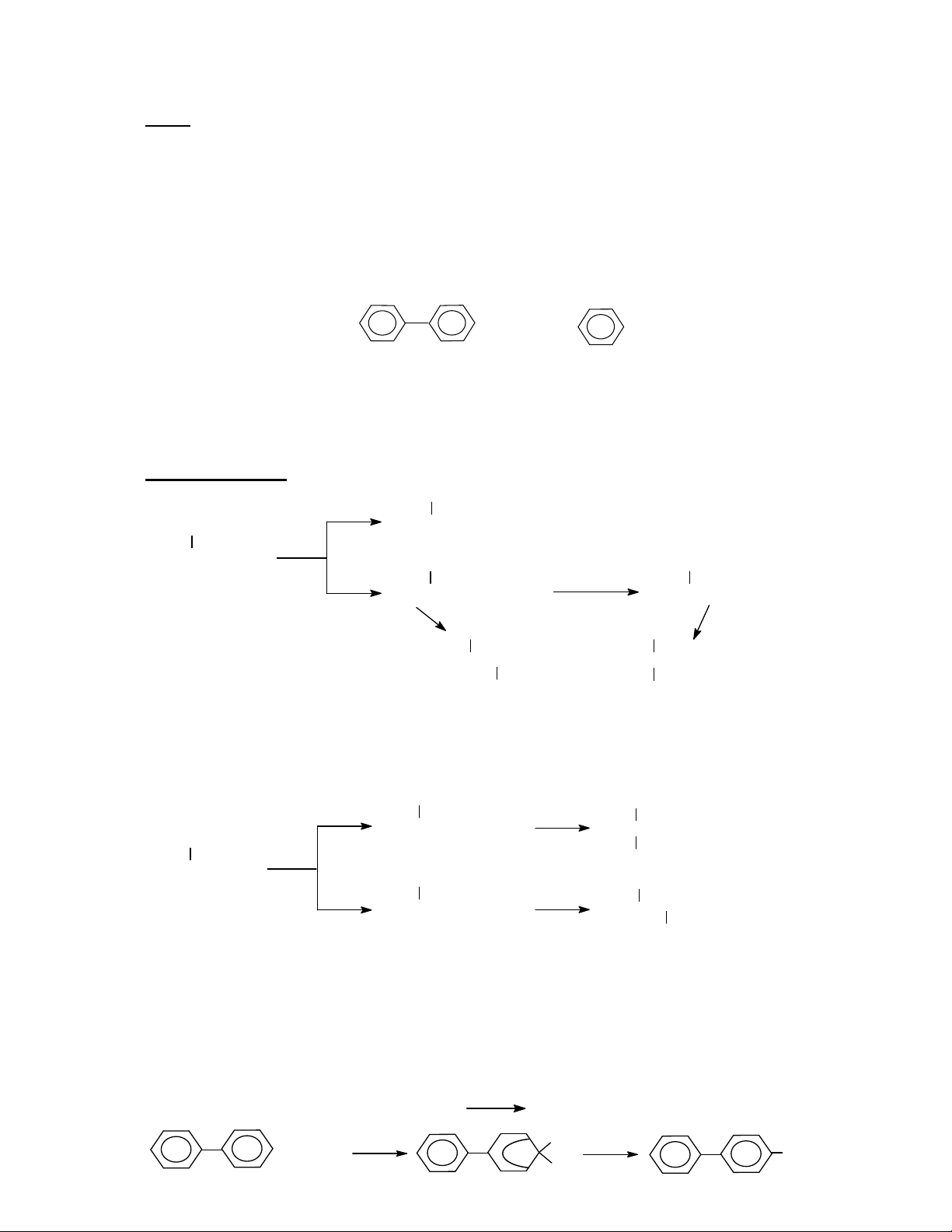
3. Trong phản ứng clo hoá nhờ chất xúc tác FeCl3 , khả năng phản ứng tương đối ở các vị
trí khác nhau trong các phân tử biphenyl và benzen như sau:
790 790 11
11
11
0 250
0 250 250 0
250 0
a) Trình bày cơ chế phản ứng clo hoá biphenyl theo hướng ưu tiên nhất.
b) Tốc độ monoclo hoá biphenyl và benzen hơn kém nhau bao nhiêu lần?
c) Trong một phản ứng clo hoá biphenyl thu được 10 gam 2-clobiphenyl, sẽ thu được
bao nhiêu gam 4-clobiphenyl?
Hướng dẫn giải:
H+
CH3-CH-CH-CH3
CH3
CH3-CH-CH2-CH2
CH3+
+
chuyÓn vÞ
(I)
(II) (III)
2-Clo-2-metylbutan2-Clo-3-metylbutan
CH3-C-CH2-CH3
CH3
+Cl-
Cl-
CH3-CH-CH=CH2
CH3
CH3-CH-CH-CH3
CH3
Cl
CH3-C-CH2-CH3
CH3
Cl
1.
Do cacbocation bậc hai (II) có khả năng chuyển vị hiđrua tạo thành cacbocation bậc ba
(III) nên tạo thành hai sản phẩm A, B.
2.
H+
Cl-
CH3-C-CH2-CH3
CH3
+(I)
CH3-C-CH-CH3
CH3
+(II)
2-Clo-2-metylbutan
CH3-C=CH-CH3
CH3
Cl-
CH3-C-CH2-CH3
CH3
Cl
2-Clo-3-metylbutan
CH3-CH-CH-CH3
CH3
Cl
2-Clo-2-metylbutan là sản phẩm chính.
Do cacbocation bậc ba (I) bền hơn cacbocation bậc hai (II), mặt khác do cacbocation bậc
hai (II) có khả năng chuyển vị hiđrua tạo thành cacbocation bậc ba (I) nên sản phẩm 2-
clo-2-metylbutan là sản phẩm chính.
3.
a) Cơ chế SE2 , ưu tiên vào vị trí cacbon số 4.
Cl2 + FeCl3 Cl+FeCl4
-
+Cl+Cl
- H+
nhanh
chËm
Cl
H
+

2 CTHC
Tốc độ monoclo hoá của biphenyl hơn benzen 430 lần.
c) Đặt x là số gam 4-clobiphenyl, ta có:
Câu II (4,75 điểm): 1. 1 điểm ; 2. 1 điểm ; 3. 2,75 điểm
1. Từ etilen và propilen có xúc tác axit, platin và điều kiện cần thiết, hãy viết sơ đồ tổng
hợp isopren.
2. Cho sơ đồ sau:
Viết công thức các sản phẩm hữu cơ A, B, C và D.
3. Từ axetilen và các hoá chất vô cơ cần thiết, hãy viết các phương trình phản ứng tạo ra
p-(đimetylamino)azobenzen:
N CH3
NN
CH3
Hướng dẫn giải:
1.
CH2=CH2
H+
CH3-CH2
+
cacbocation này alkyl hoá propen
CH2=CH-CH3
CH3-CH2-CH2-CH-CH3
+
CH3-CH2
+
CH3-CH2-CH=CH-CH3
CH3-CH2-CH-CH2
+
CH3
- H+
- H+
CH3-CH2-C=CH2
CH3
(II)
H+
CH3-CH=CH2
CH3-CH-CH3
CH3-CH2-CH2
+
+
CH2=CH2
CH2=CH2
(IV)
CH3-CH2-CH2-CH-CH2
+
CH3-CH-CH2-CH2
CH3
+
- H+
- H+
CH3-CH2-CH2-CH-CH2
+
CH3-CH2-CH2-CH=CH2
CH3-CH-CH=CH2
CH3
CH3-CH-CH2-CH2
CH3
+
Tách (II) và (IV) ra khỏi hỗn hợp:
Xiclohexanol HBr A
Br
3.
1. Li
2. CuI B(NBS) CN2H4 /O2DKOH
C2H5OH
CH2
CH2C
O
C
O
NBr
kbiphenyl (250 4) + (790 2) 430
k
benzen
1 6 1
x 790
2 790
2
10
10 250 4 1000
x
15,8 (g)
b)




![10 Đề kiểm tra 1 tiết Hoá lớp 12 [Kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111025/tottenham6811/135x160/mot_so_de_kiem_tra_1587.jpg)
![Đề kiểm tra Hoá 12 học kỳ 2: Tuyển tập đề 1 tiết [kèm đáp án]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111025/tottenham6811/135x160/kiem_tra_sat_6881.jpg)






![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








