
TRƯỜNG ĐẠI HỌC BÁCH KHOA TP.HCM
KHOA KỸ THUẬT HÓA HỌC
BỘ MÔN CHẾ BIẾN DẦU KHÍ
TRANSPORT
PHENOMENA
(Chương 6&7)
GVHD: Mai Thanh Phong
HVTH: Phan Hồng Phương
Đào Thị Thanh Xuân
2010
6. ĐỊNH LUẬT BẢO TOÀN TRONG TRUYỀN VẬN ỔN ĐỊNH
Việc sử dụng những mối tương quan trong việc xác định sự truyền động lượng, truyền năng lượng và
truyền khối từ pha này sang pha khác dưới những điều kiện trạng thái ổn định đã được trình bày trong
chương 4. Mặc dù một vài ví dụ trong chương 4 sử dụng sự bảo toàn vĩ mô, việc giải quyết có hệ
thống của những cân bằng này cho sự bảo toàn chemical species, khối lượng và năng lượng không
được trình bày. Những bước cơ bản trong sự phát triển của cân bằng trạng thái ổn định vĩ mô được liệt
kê như sau:
Định nghĩa hệ thống của bạn: Một hệ thống là bất cứ vùng nào chiếm thể tích và có một đường
ranh giới.
Nếu có thể, hãy vẽ một bức phác họa đơn giản: Một bức phác họa đơn giản giúp chúng ta hiểu
được những hình ảnh vật lý.
Liệt kê những giả định: Đơn giản hóa vấn đề phức tạp thành một dạng toán học dễ xử lý bằng
cách tiến hành những giả định hợp lý.
Viết phương trình tỷ lệ tóm tắt cho mỗi khái niệm cơ bản liên quan tới vấn đề sắp tới: Khi số
hạng tích lũy triệt tiêu trong những trường hợp trạng thái ổn định, những phương trình tỷ lệ vĩ
mô dễ xử lý giảm thành những phương trình đại số. Chú ý rằng để có một hệ toán học xác
định, số phương trình tỷ lệ độc lập dễ xử lý phải bằng số biến không độc lập.
Sử dụng những tương quan khoa học kỹ sư để đánh giá các hệ số truyền vận: Trong mô hình
vĩ mô, những phương trình thực nghiệm thể hiện hiện tượng truyền vận từ pha này sang pha
khác đều chứa hệ số truyền vận, như hệ số truyền nhiệt trong định luật làm mát của Newton.
Những hệ số này có thể được đánh giá bằng cách sử dụng những tương quan khoa học kỹ sư
được đưa ra trong chương 4.
Giải các phương trình đại số.
6.1 SỰ BẢO TOÀN CÁC THÀNH PHẦN HÓA HỌC:
Phương trình tỷ lệ tóm tắt được đưa ra bởi phương trình(1.1-1) chứa mỗi lượng bảo toàn. Vì vậy, phát
biểu sự bảo toàn cho khối lượng của cấu tử hóa học thứ i dưới điều kiện ổn định được trình bày như
sau:
( tỷ lệ khối lượng của i vào) – ( tỷ lệ khối lượng của i ra) + ( tỷ lệ khối lượng phát sinh i) = 0 (6.1-1)
Khối lượng của i có thể vào hoặc ra hệ thống bằng 2 phương tiện:
(i) Bằng những dòng vào hoặc ra,
(ii) Bằng trao đổi khối lượng giữa hệ và môi trường quanh nó qua những ranh giới của hệ thống,
ví dụ bề mặt truyền khối.
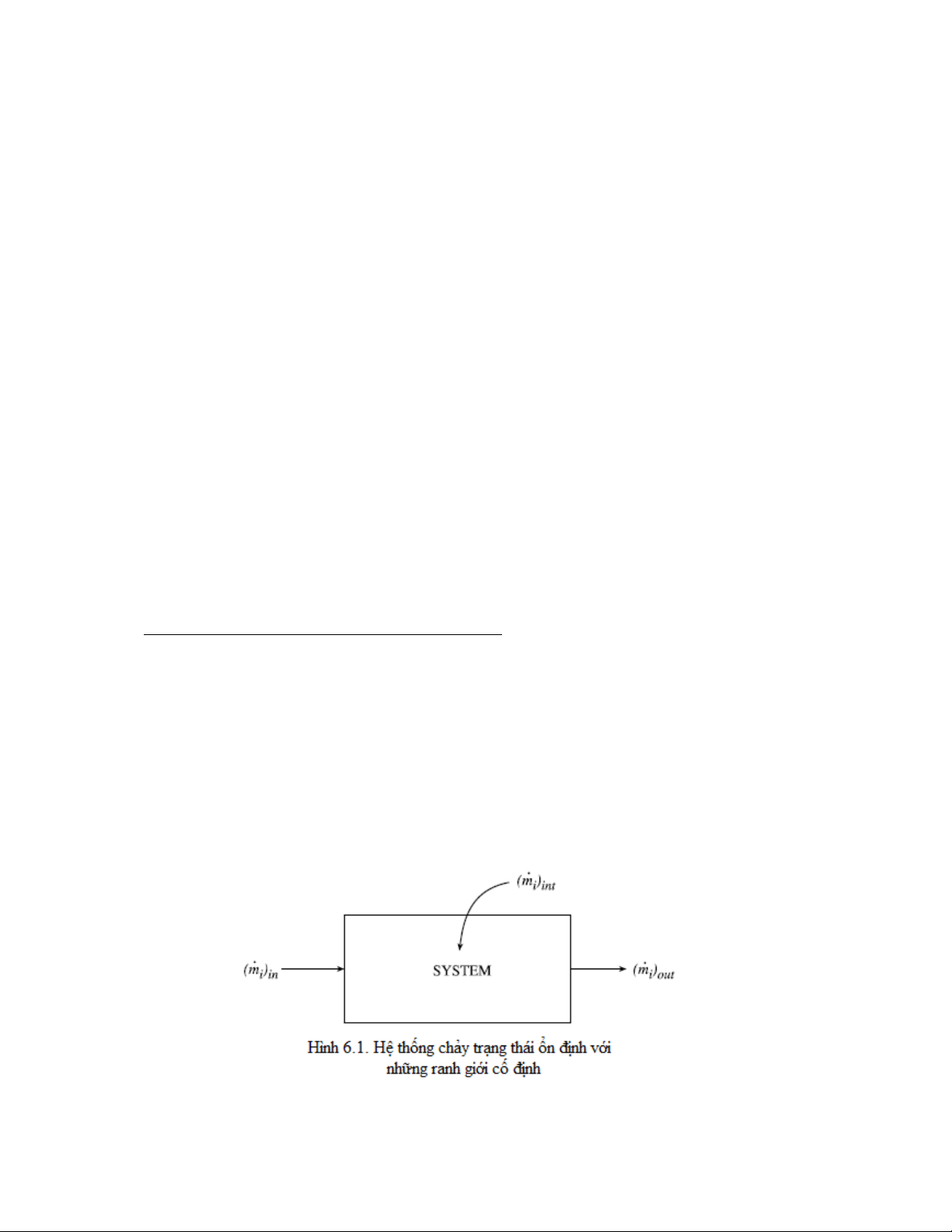
Cho một hệ thống với một dòng vào và một dòng ra như hình 6.1, phương trình (6.1-1) có
thể được biểu diễn như sau:

Trong đó, tỷ lệ mol của sự sinh ra cấu tử i/ đơn vị thể tích , được thể hiện bởi phương trình (5.3-
27). Số hạng và biểu thị lưu lượng khối vào và ra của cấu tử thứ i, và là khối
lượng phân tử của cấu tử thứ i. Tốc độ truyền khối ở bề mặt tiếp xúc, , được biểu diễn như sau:
Trong đó là độ chênh lệch nồng độ đặc trưng. Chú ý rằng được xem là dương khi
khối lượng được thêm vào hệ.
Như đã nói trong phần 2.4.1, lưu lượng khối của cấu tử thứ i, ,được tính bởi:
Do đó, phương trình (6.1-2) có dạng:
Đôi khi làm việc trên nền tảng mol thì tiện hơn. Chia phương trình (6.1-2) và (6.1-5) cho khối lượng
phân tử của cấu tử thứ i, , dẫn đến:
và
trong đó, và là lưu lượng mol và nồng độ mol của cấu tử thứ i.
6.2 SỰ BẢO TOÀN KHỐI LƯỢNG:
Tổng của phương trình (6.1-2) cho tất cả các chất thành phần đưa đến cân bằng tổng khối lượng dưới
dạng:

Lưu ý rằng số hạng
Bởi vì khối lượng được bảo toàn. Phương trình (6.2-1) chỉ ra rằng tỷ lệ khối lượng tạo thành cho toàn
hệ bằng 0. Tuy nhiên, nếu các phản ứng hóa học xảy ra bên trong hệ,một loại riêng có thể được tạo
thành.
Mặt khác, tổng của phương trình (6.1-6) cho tất cả các chất thành phần đưa đến cân bằng mol tổng
như sau:
Trong trường hợp số hạng phát sinh khác 0 bởi vì mol thì không được bảo toàn.
6.3. SỰ BẢO TOÀN NĂNG LƯỢNG:
Phát biểu sự bảo toàn cho năng lượng tổng dưới điều kiện ổn định có dạng:
Định luật thứ nhất của nhiệt động học phát biểu rằng năng lượng tổng có thể không được tạo thành
hoặc không bị tiêu hủy. Vì vậy, số hạng lượng năng lượng phát sinh trong phương trình (6.3-1) bằng
0.
Năng lượng có thể vào hoặc ra khỏi hệ bằng 2 con đường: (i) bằng dòng vào hoặc ra, (ii) bằng cách
trao đổi năng lượng giữa hệ và môi trường xung quanh qua những ranh giới của hệ dưới dạng nhiệt và
công.
Cho 1 hệ với 1 dòng vào và 1 dòng ra như trong hình 6.2, phương trình (6.3-1) có thể được biểu thị
như sau:
Trong đó lượng truyền nhiệt giữa các pha, , được biểu diễn:
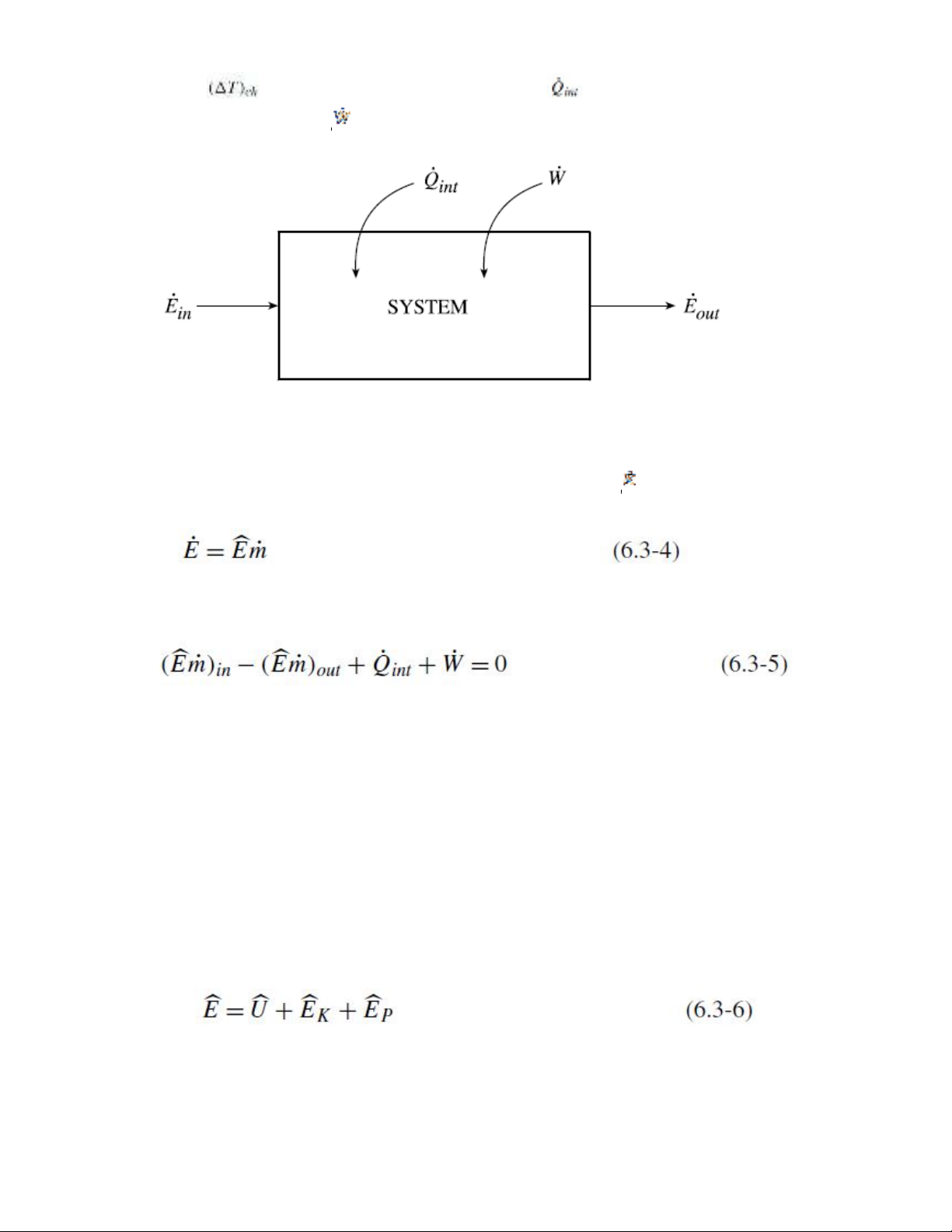
Trong đó là chênh lệch nhiệt độ đặc trưng. Chú ý rằng được coi là dương khi năng lượng
được thêm vào hệ. Tương tự, được coi là dương khi công được thực hiện lên hệ.
Hình 6.2. Hệ trạng thái ổn định với các ranh giới cố định trao đổi năng lượng dưới dạng nhiệt và công
với môi trường.
Như đã phát biểu trong phần 2.4.2, lượng năng lượng vào hoặc ra khỏi hệ, , được biểu diễn:
Do đó, phương trình (6.3-2) trở thành:
Để xác định năng lượng tổng trên đơn vị khối lượng,, xem xét một phi hành gia trên tàu vũ trụ
Atlantis. Khi phi hành gia nhìn vào trái đất, anh (chị) ấy thấy rằng trái đất có một động năng ngoài nhờ
vào sự quay và chuyển động của nó quanh mặt trời. Trái đất cũng có một động năng trong như một kết
quả của tất cả các vật thể, ví dụ, con người, xe cộ, máy bay,..., di chuyển trên bề mặt của nó mà phi
hành gia không thể nhìn thấy. Một vật thể luôn được cấu thành bởi những vật thể nhỏ hơn, mỗi vật thể
nhỏ có thể có nội năng và ngoại năng. Tổng của nội năng và ngoại năng của những vật thể nhỏ hơn
luôn luôn hiển thị như nội năng của những vật lớn hơn.
Thảo luận trên chỉ rằng năng lượng tổng của bất cứ hệ nào được biểu diễn là tổng của nội năng và
ngoại năng của nó. Động năng và thế năng tạo thành ngoại năng, trong khi năng lượng liên quan đến
chuyển động tịnh tiến, quay và dao động của các nguyên tử và phân tử được coi là nội năng. Do đó,
năng lượng tổng trên đơn vị khối lượng có thể được biểu diễn:
trong đó biểu thị nội năng, động năng và thế năng trên đơn vị khối lượng.Từ phương trình (6.3-6),
(6.3-5) ta được:



















![Tính toán thiết bị trao đổi nhiệt ống chùm thẳng đứng: Bài tập lớn [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/kimphuong1001/135x160/93311754362991.jpg)






