
ĐỊNH LUẬT BẢO TOÀN TRONG
TRUYỀN VẬN ỔN ĐỊNH
6.1 SỰ BẢO TOÀN CÁC THÀNH PHẦN HÓA HỌC.
6.2 SỰ BẢO TOÀN KHỐI LƯỢNG.
6.3 SỰ BẢO TOÀN NĂNG LƯỢNG.
6.3.1 SỰ BẢO TOÀN NĂNG LƯỢNG CHO HỆ KHÔNG XẢY RA
PHẢN ỨNG HÓA HỌC
6.3.2 SỰ BẢO TOÀN NĂNG LƯỢNG CHO HỆ XẢY RA PHẢN ỨNG
HÓA HỌC.
6.4 CÂN BẰNG NĂNG LƯỢNG TRONG LÒ PHẢN ỨNG KHUẤY
LIÊN TỤC.

TRƯỜNG ĐẠI HỌC BÁCH KHOA TP.HCM
KHOA KỸ THUẬT HÓA HỌC
BỘ MÔN CHẾ BIẾN DẦU KHÍ
TRANSPORT
PHENOMENA
(Chương 6&7)
GVHD: Mai Thanh Phong
HVTH: Phan Hồng Phương
Đào Thị Thanh Xuân

•Sự bảo toàn khối lượng của cấu tử hóa học thứ i dưới điều kiện ổn định
được trình bày như sau:
•Khối lượng của i có thể vào hoặc ra hệ thống bằng 2 phương tiện:
-Bằng những dòng vào hoặc ra,
-Bằng trao đổi khối lượng giữa hệ và môi trường quanh nó qua những ranh
giới của hệ.
( lưu lượng khối của i vào) –( lưu lượng khối của i ra)
+ ( lưu lượng khối i phát sinh) = 0 (6.1-1)
6.1.SỰ BẢO TOÀN CỦA CÁC THÀNH PHẦN HÓA HỌC
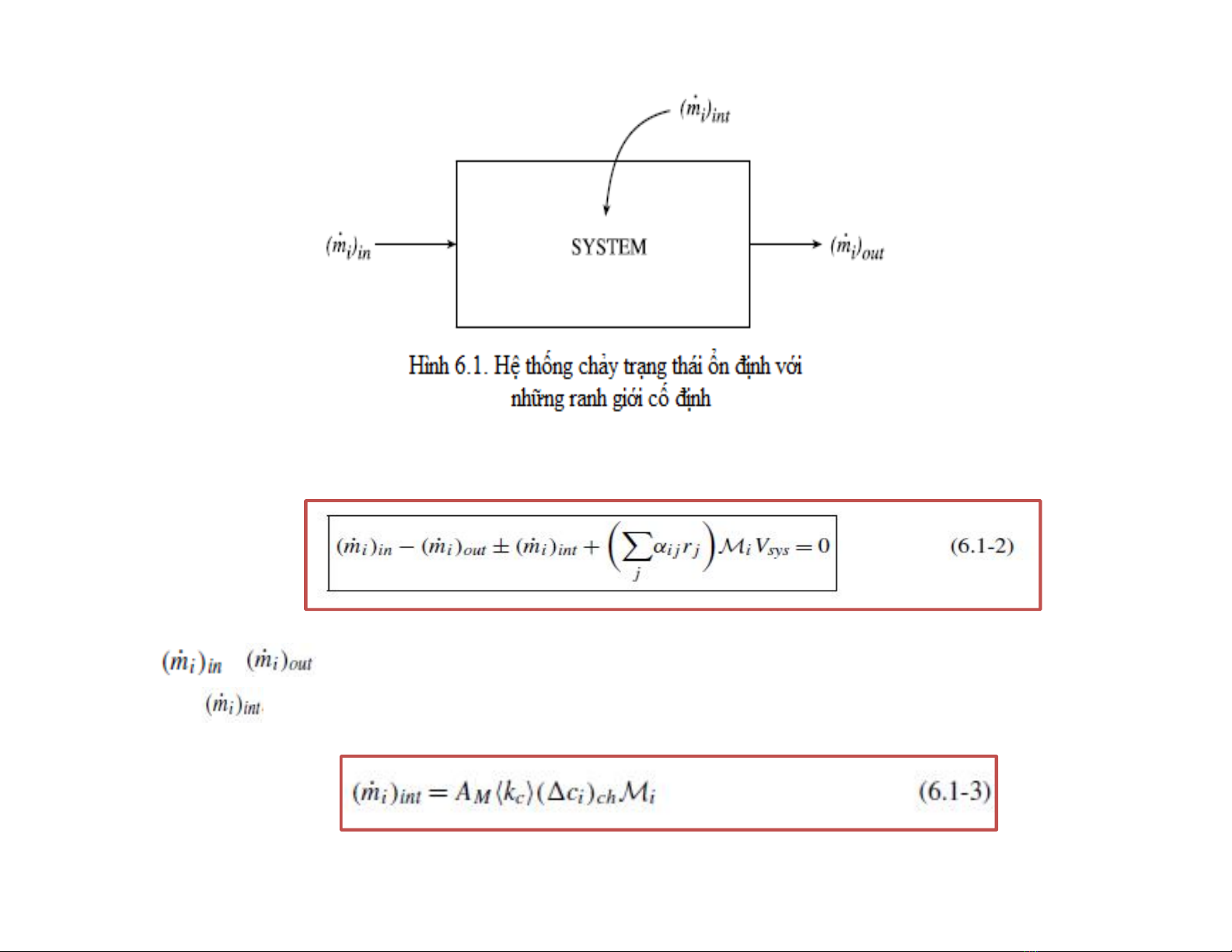
Phương trình (6.1-1) cho hệ trong hình 6.1 có thể được biểu diễn như sau:
lưu lượng khối vào và ra của cấu tử thứ i
lưu lượng khối ở bề mặt tiếp xúc

chênh lệch nồng độ đặc trưng
Lưu lượng khối của cấu tử thứ i:
Do đó, phương trình (6.1-2) có dạng:
Chia phương trình (6.1-2) và (6.1-5) cho khối lượng phân tử của cấu
tử thứ i:

















![Ô nhiễm môi trường không khí: Bài tiểu luận [Nổi bật/Chi tiết/Phân tích]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251011/kimphuong1001/135x160/76241760173495.jpg)







![Ứng dụng kỹ thuật trao đổi ion trong điện phân: Bài tiểu luận [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250829/sonphamxuan1808/135x160/97341756442892.jpg)
