
Bài 35: ANKAN. TÍNH CH T HÓA H C, ĐI U CHẤ Ọ Ề Ế
VÀ NG D NGỨ Ụ
I/ TÍNH CH T HÓA H C:Ấ Ọ
Các liên k t trong phân t ankan là liên k t σ b n v ng nên nhi t đ th ng ankanế ử ế ề ữ ở ệ ộ ườ
t ng đ i tr v m i m t hóa h c: không ph n ng v i axit, baz và các ch t oxi hóaươ ồ ơ ề ọ ặ ọ ả ứ ớ ơ ấ
m nh (không làm m t màu dd KMnOạ ấ 4) Nên ankan còn có tên là parafin ít ái l c hóa h c.ụ ọ
Ph n ng đ c tr ng c a ankan là ph n ng th v i halogen:ả ứ ặ ư ủ ả ứ ế ớ
1.Ph n ng th :ả ứ ế
V i ph n ng t l 1:1, ankan có bao nhiêu v trí cacbon khác nhau còn hiđro thì b yớ ả ứ ỉ ệ ị ấ
nhiêu s n ph m d n xu t monohalogen c a ankan. S n ph m trong đó halogen th hiđroả ẩ ẫ ấ ủ ả ẩ ế
c a cacbon b c cao là s n ph m chính.ủ ậ ả ẩ
VD:
*Chú ý:
- V i clo: đi u ki n ph n ng là ánh sáng khuy ch tán.ớ ề ệ ả ứ ế
- V i Brom: đi u ki n ph n ng trên 100ớ ề ệ ả ứ oC và brom ch th H c a cacbon b t cao.ỉ ế ủ ậ
- V i flo: ch ph n ng mãnh li t nên phân h y ankan thành C và F.ớ ỉ ả ứ ệ ủ
- V i iot quá y u nên không ph n ng.ớ ế ả ứ
Các đ ng đ ng c a metan c a tham gia ph n ng th t ng t nh metan:ồ ẳ ủ ủ ả ứ ế ươ ự ư
CH3 – CH2 – CH3 + Cl2 CH3 – CHCl – CH3 + CH3 – CH2 Cl +HCl
2-clopropan 57% 1-clopropan 43%
C ch ph n ng halogen hóa ankan x y ra theo c ch g c dây chuy n (Sgk).ơ ế ả ứ ả ơ ế ố ề
2. Ph n ng tách:ả ứ
a/ Tách hiđro (đ hiđro hóa):ề
CnH2n+2 H2 + CnH2n (anken)
(n ≥ 2)
CnH2n+2 2H2 + CnH2n-2 (ankađien)
(n ≥ 1)
VD:
CH3 – CH3 CH2 CH2 + H2
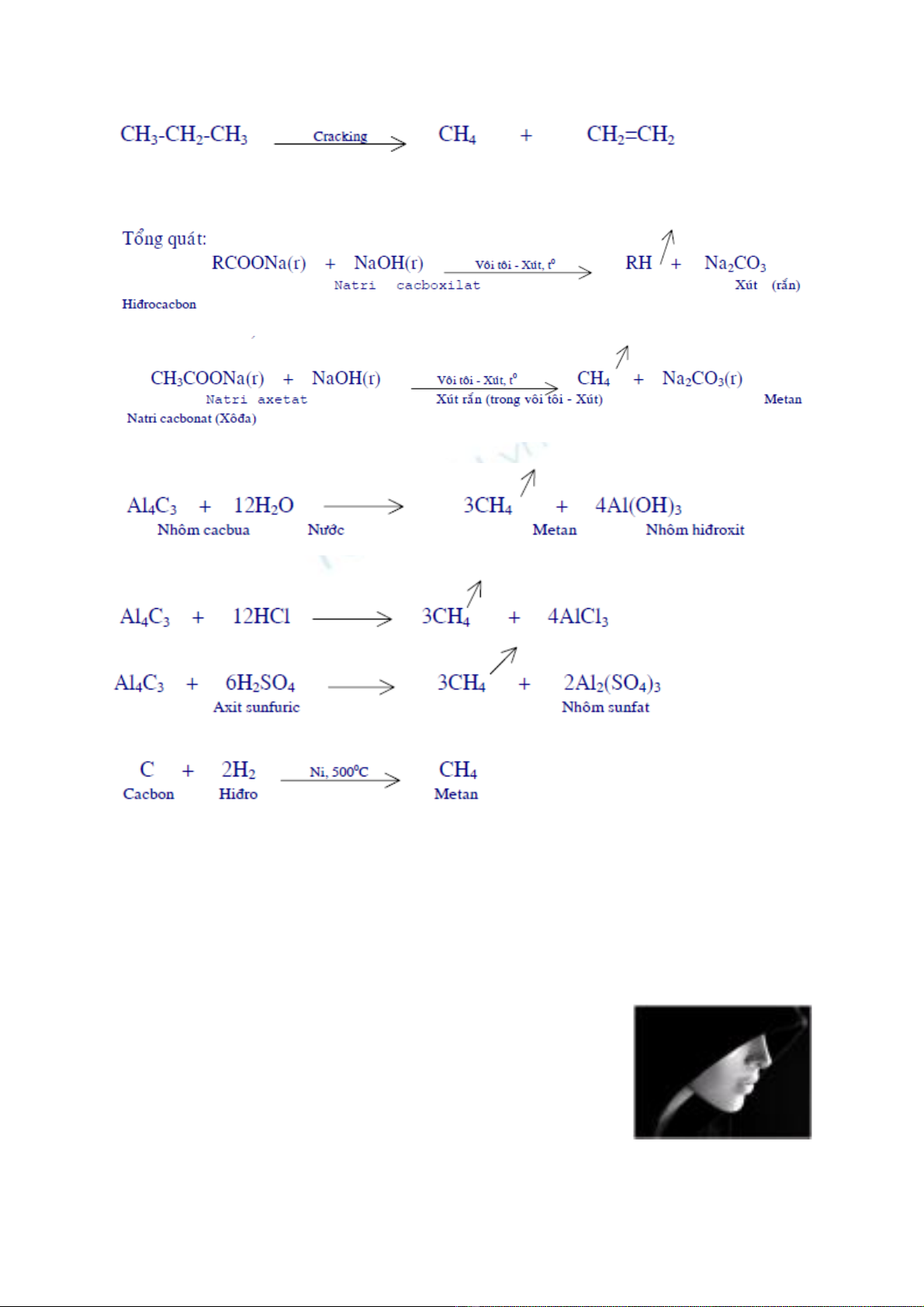
b.Cracking:

























![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)





