
1
§3. ÁP DỤNG NGUYÊN LÝ II CỦA NĐH
VÀO HÓA HỌC – CHIỀU VÀ GIỚI HẠN
TỰ DIỄN BIẾN CỦA QUÁ TRÌNH
Quá trình tự diễn biến và Quá trình không tự diễn biến:
Quá trình tự diễn biến Quá trình ko tự diễn biến
Là quá trình trong những
điều kiện nhất định nó tự
xảy ra mà không cần tiếp
thêm năng lượng liên tục từ
bên ngoài vào hệ.
Là quá trình không thể tự
động xảy ra nếu hệ không
được cung cấp năng lượng
liên tục từ bên ngoài.
-
Nước: cao thấp
-
Tốn năng lượng liên tục để
đưa
nước lên cao
-
Nhiệt: nóng lạnh
-
Tốn năng lượng để nóng lên
-
Khí: p cao p thấp
-
Tốn công để nén khí
2

I. Nguyên lý II của nhiệt động học:
1. Entropi (S) - Biểu thức toán học của nguyên lý II
Có nhiều cách phát biểu nguyên lý II, trong hóa học, phát biểu nguyên lý II
dưới dạng hàm trạng thái entropi là thuận lợi nhất.
Phát biểu: - Tồn tại một hàm trạng thái gọi là entropi, kí hiệu là S.
Vậy dS là một vi phân toàn phần.
-Nếu trong sự biến đổi thuận nghịch vô cùng nhỏ ở T = const, hệ trao đổi với
môi trường một nhiệt lượng 𝛿QTN thì biến thiên entropi trong quá trình này
sẽ là: dS = 𝛿QTN
T
Vì entropi là hàm trạng thái nên khi hệ chuyển từ trthái (1) sang trthái (2)
thì biến đổi entropi sẽ là:
ΔS= 𝑺𝟐− 𝑺𝟏=
𝛿QTN
T
𝟐
𝟏
-Nếu biến đổi là bất thuận nghịch thì: dS > 𝛿QBTN
T
ΔS= 𝑺𝟐− 𝑺𝟏=
𝛿QBTN
T
𝟐
𝟏 3

I. Nguyên lý II của nhiệt động học:
Biểu thức toán học của nguyên lý II:
Dấu “=“: qtr thuận nghịch (CB)
Dấu “>“: qtr bất thuận nghịch
(tự xảy ra)
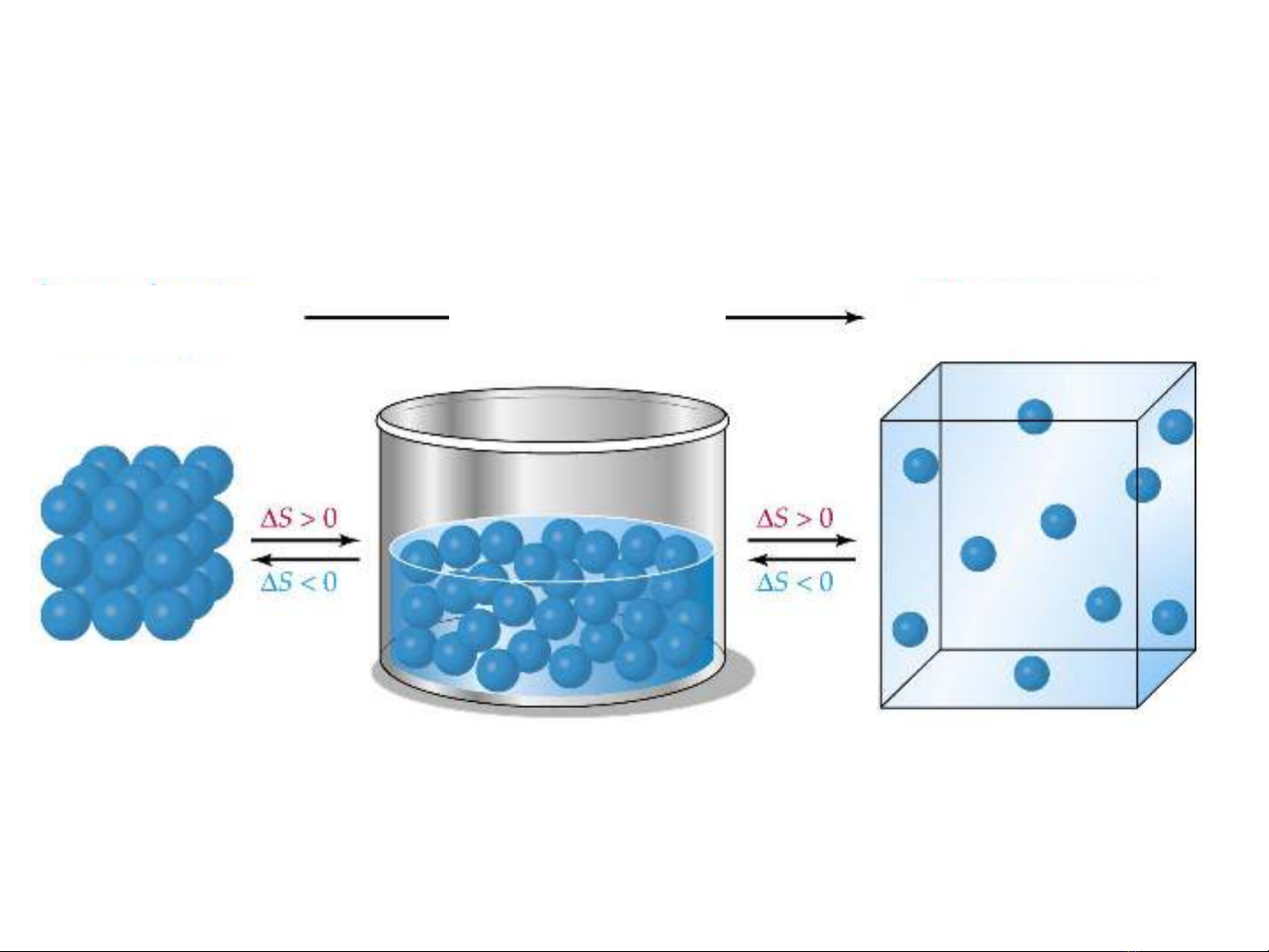
S: entropi, hàm trạng thái đặc trưng cho độ hỗn độn của hệ
hệ càng hỗn độn, S càng lớn: SK > SL > SR
Đối với hệ cô lập: dS 0
4
T
Q
dS
2
1T
Q
S
5
Tính hỗn
loạn Entropi
Entropi
Rắn Lỏng Khí


























