

2
ĐẠI HỌC THÁI NGUYÊN
TRƯỜNG ĐẠI HỌC KHOA HỌC
PHAN HÙNG CƯỜNG
ỨNG DỤNG PHƯƠNG PHÁP PHÂN TÍCH TRẮC QUANG
ĐÁNH GIÁ KHẢ NĂNG QUANG XÚC TÁC PHÂN HỦY
MỘT SỐ HỢP CHẤT NHÓM PHENOL CỦA
VẬT LIỆU TỔNG HỢP ZnO
LUẬN VĂN THẠC SĨ HÓA HỌC
THÁI NGUYÊN - 2017

3
Chương 1
TỔNG QUAN
1.1. Kẽm và Kẽm Oxit
1.1.1. Kẽm
Kẽm là một nguyên tố kim loại chuyển tiếp, thuộc nhóm IIB, chu kì 4, ký hiệu
là Zn và có số hiệu nguyên tử là 30 trong bảng tuần hoàn. Trong các hợp chất, Zn có
số oxi hóa là +2.
Cấu hình electron nguyên tử Zn : [ Ar ]3d104s2
Kẽm có màu trắng xanh, óng ánh và nghịch từ. Phân bố tinh thể của kẽm loãng
hơn sắt và có cấu trúc tinh thể sáu phương với một kết cấu lục giác không đều. Kẽm
kim loại cứng và giòn ở hầu hết nhiệt độ, nhưng trở lên dễ uốn từ 100 đến 150 0C.
Kẽm có độ nóng chảy (419,5 0C, 787,1 0F ) và điểm sôi 907 0C. Kẽm có khối
lượng riêng 7140 kg/m3, độ cứng 2,5. Độ dẫn điện 1,695 * 107 Ω·m.
Sphalerit là khoáng vật quặng kẽm chủ yếu. Nó bao gồm phần lớn kẽm
sulfua ở dạng kết tinh nhưng nó luôn chứa hàm lượng sắt thay đổi, là loại quặng
chứa nhiều kẽm nhất với hàm lượng kẽm lên tới 60 đến 62%. Khi hàm lượng
sắt cao nó chuyển sang màu đen mờ gọi là marmatit [4].
Zn mang đầy đủ tính chất hóa học chung của kim loại, ngoài ra nó còn có
tính chất riêng.
Tác dụng với dung dịch bazo.
Zn + 2NaOH Na2ZnO2 + H2
Tác dụng với dung dịch axit.
Zn + HNO3 đ 4Zn(NO2)2 + 2NO2 + H2O
Tùy lượng HNO3 có thể bị khử thành nhiều sản phẩm khác nhau tạo 2NO2,
NO, N2O.
Ứng dụng. Kẽm chủ yếu được dùng làm lớp chống ăn mòn. Sử dụng làm vật
liệu anot cho pin. ..
1.1.2. Oxit kẽm (ZnO)
4
Oxit kẽm ZnO là chất bột màu trắng khó nóng chảy (nhiệt độ nóng chảy
ở19500C), có khả năng thăng hoa, không phân hủy khi đun nóng, hơi rất độc,
màu trắng ở nhiệt độ thường, màu vàng khi đun nóng [4]. ZnO tồn tại ở 3 dạng
cấu trúc đó là:
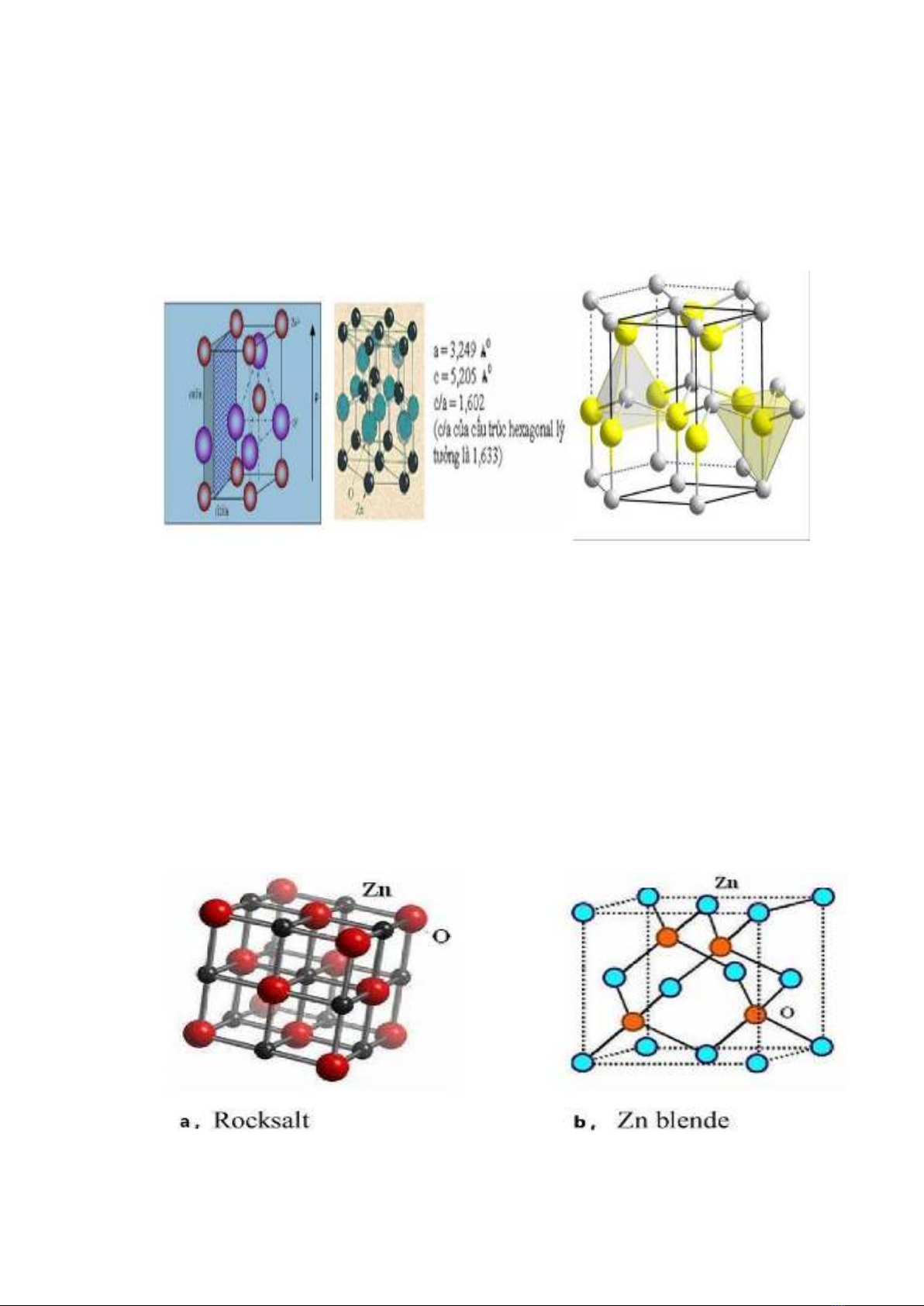
Hình 1.1. Cấu trúc wurtzite của ZnO
Đây là cấu trúc bền, ổn định nhiệt nên là cấu trúc phổ biến nhất.Với cấu
trúc này, mỗi nguyên tử Oxi liên kết với 4 nguyên tử kẽm và ngược lại.Trong
cấu trúc wurtzite, mỗi ô đơn vị của ZnO chứa 2 nguyên tử oxi và 2 nguyên tử kẽm.
- Cấu trúc Rocksalt và Zn blende (hình 1.2), trong đó cấu trúc Rocksalt
chỉ tồn tại dưới điều kiện áp suất cao và cấu trúc Blende chỉ kết tinh được trên
đế lập phương.

5
Hình 1.2. Cấu trúc Rocksalt (a) và Blende (b) của ZnO
Trong tinh thể ZnO thực luôn có những nguyên tử (hoặc ion) có thể bật ra
khỏi vị trí nút mạng để lại những vị trí trống. Oxit nano ZnO có nhiều hình
dạng khác nhau như màng mỏng, sợi nano, dây nano, thanh nano, ống nano hay
tồn tại ở dạng lá, dạng lò xo, dạng đĩa, dạng cánh hoa…( hình 1.3)
Hình 1.3. Ảnh hiển vi điện tử quét (SEM) của dây nano ZnO (a);
ZnO dạng lò xo (b); ZnO dạng lá kim (c)
Tùy vào ứng dụng mà người ta sẽ tổng hợp oxit nano ZnO có những dạng
hình thái khác nhau. Ví dụ transitor màng mỏng ZnO (thin film transitors –
TFTs) được ứng dụng sản xuất màng ảnh do màng mỏng ZnO có độ linh động
điện tử cao. Tuy nhiên để dùng cho các hệ cảm biến khí, sợi nano ZnO được
lựa chọn vì khi tồn tại ở dạng sợi sẽ giúp tăng diện tích tiếp xúc giữa vật liệu
ZnO với khí, làm tăng đáng kể độ nhạy so với cảm biến dùng màng mỏng ZnO
[16].
Oxit ZnO có pha tạp thêm các ion kim loại được ứng dụng nhiều trong
thực tế như chế tạo tạo thiết bị cảm biến khí cực kì nhạy cảm với CO [21], sử
dụng làm điện cực trong nhiều thiết bị điện tử như pin mặt trời, màn hình điện
phát quang [24], dùng trong thiết bị cảm biến khí ga [25]...
Với các tính chất về quang, điện, hóa học, tính áp điện của ZnO nên ứng
dụng của loại vật liệu này cũng đa dạng và phong phú. ZnO có cấu trúc nano


























