
GIỚI THIỆU VỀ VẬT LIỆU
VẬT LIỆU LÀ GÌ?
VÌ SAO PHẢI HỌC VẬT LIỆU?
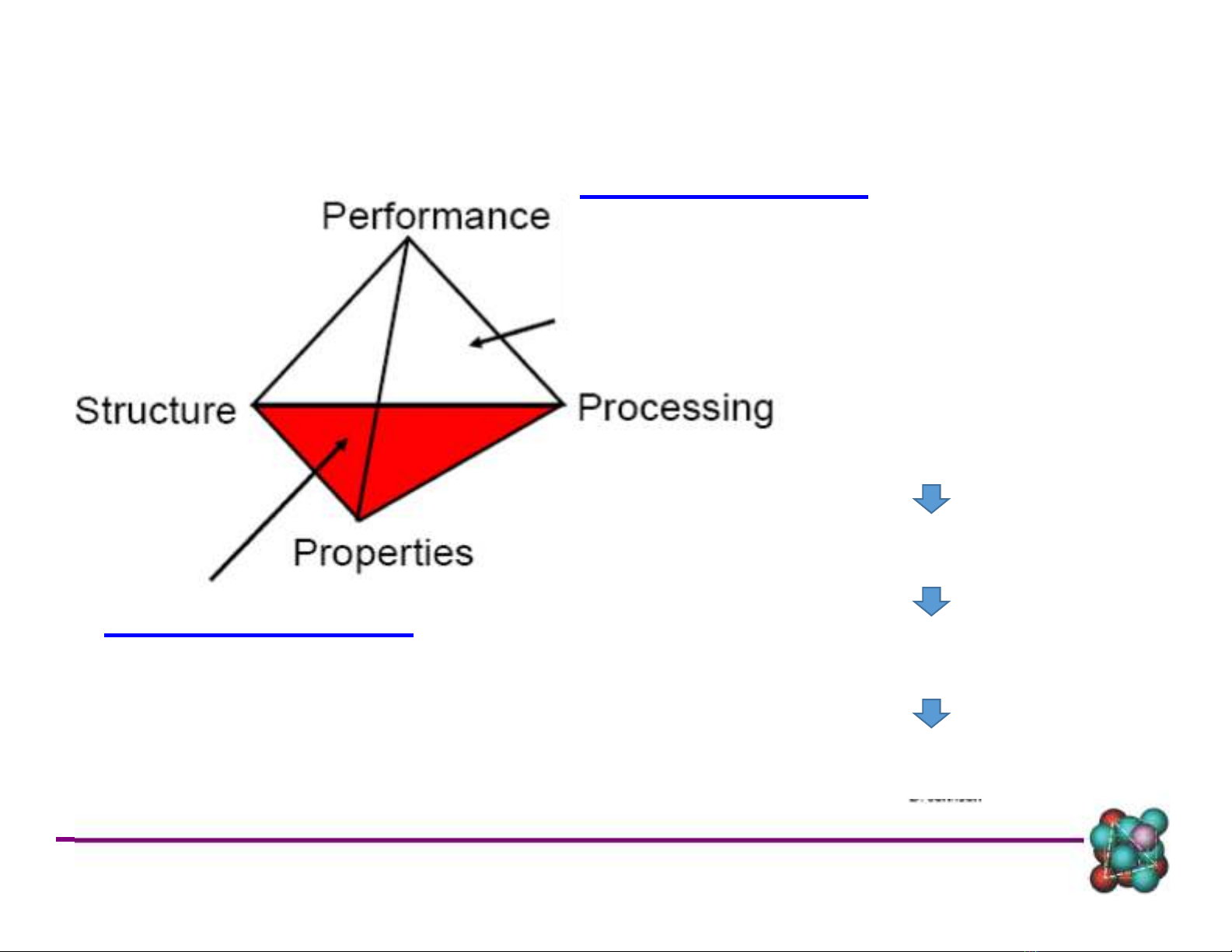
Kỹ thuật vật liệu
Thiết kế, chế tạo vật liệu có cấu
trúc phù hợp với tính chất vật
liệu theo yêu cầu sử dụng
Khoa học vật liệu
Nghiên cứu mối quan hệ giữa cấu
trúc và tính chất vật liệu
Gia công, chế tạo
Tổ chức, Cấu trúc
Tính chất
Yêu cầu sử dụng
GIỚI THIỆU VỀ VẬT LIỆU
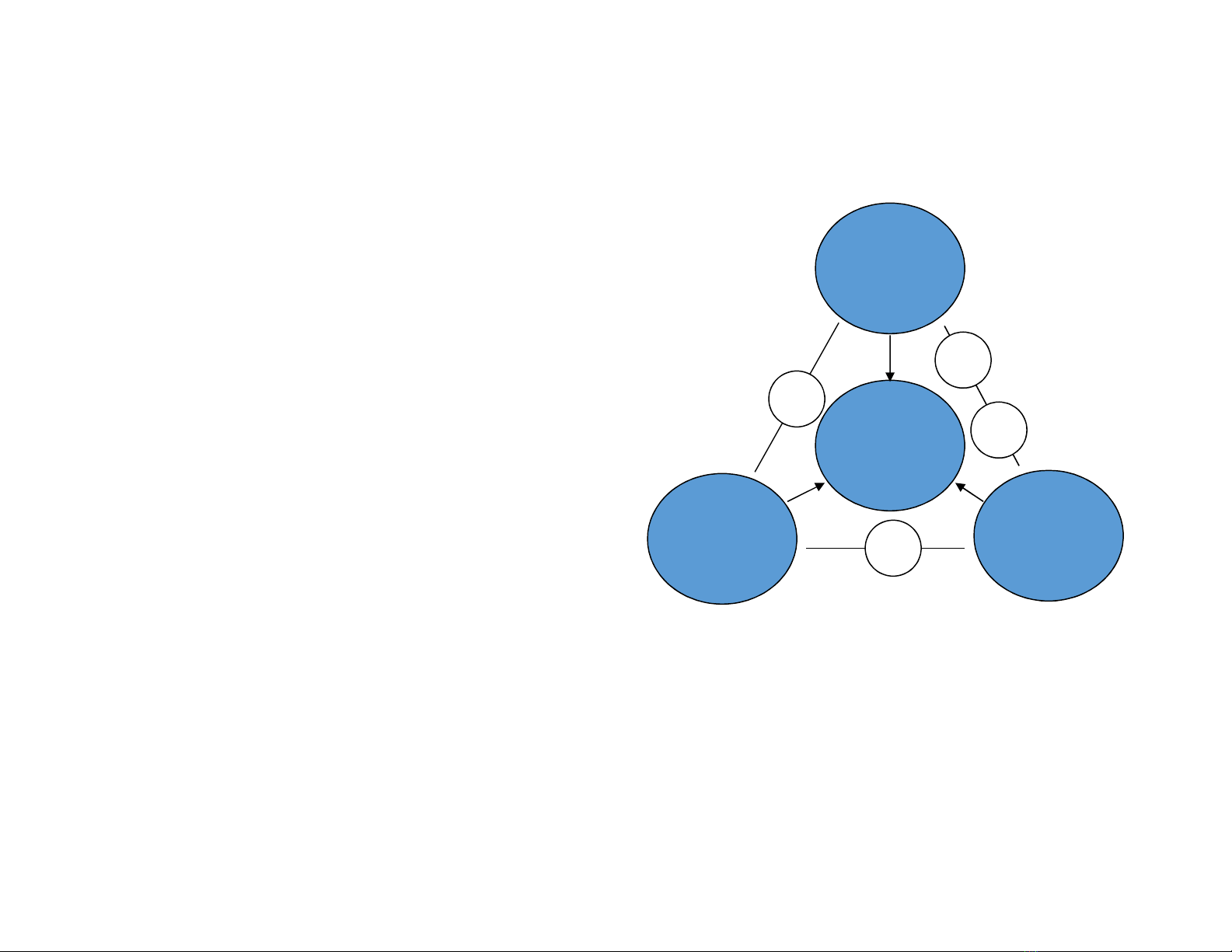
PHÂN LOẠI VẬT LIỆU
Kim
loại
Polymer Ceramic
Composite
4
1
2
3
4 nhóm vật liệu chính:
+ VL kim loại:
+ Ceramic:
+ Polymer:
+ Composite:
1- VL bán dẫn
2- VL siêu dẫn
3- VL silicon
4- VL polymer dẫn điện

Vai trò của vật liệu
Đối tượng của vật liệu học:
Mối quan hệ giữa tính chất, cấu trúc & gia công vật liệu
Thiết kế, lựa chọn, gia công vật liệu phù hợp yêu cầu sử dụng
Tính chất: - cơ học (cơ tính)
- vật lý (lý tính)
- hóa học (hoá tính)
- công nghệ và sử dụng
Cấu trúc: - cấu trúc tinh thể của vật liệu
- Tổ chức pha của vật liệu
Vật liệu kỹ thuật:
Chương 1: Cấu trúc tinh thể và sự hình thành
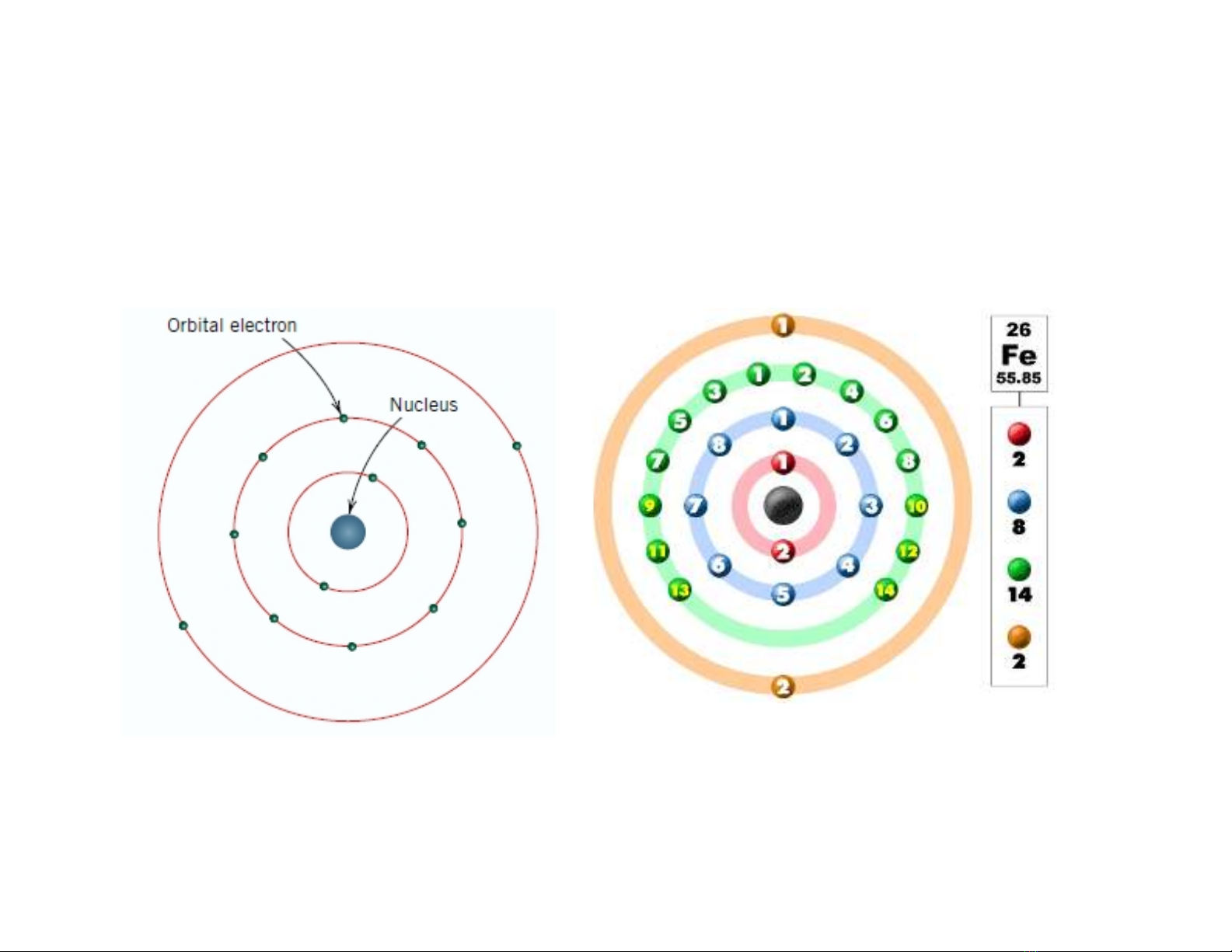
1.1 Cấu tạo và liên kết nguyên tử:
Cấu tạo nguyên tử: các e chuyển động bao quanh hat nhân (p+n)
1s22s22p63s23p63d64s2
K L M N














![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)










