
1
PHẦN 1
chương 2
PHƯƠNG PHÁP VOLT- AMPE
TS. Nguyễn Thị Hồng Hương
PGS TS Vĩnh Định
TS Phan văn Hồ Nam
Tháng 09/2014

2Mu,c tiêu ho,c tâ,p
•Giải thích được sự hình thành sóng cực phổ cổ điển và ứng dụng
của phương trình Ilcovic.
•Nhận xét ưu thế và nhược điểm của cực phổ cổ điển, từ đó nêu rõ
nguyên tắc của hai dạng cực phổ hiện đại.
•Giải thích được ứng dụng của phương pháp cực phổ.
•Vẽ và giải thích các dạng đường cong chuẩn độ ampe kép.
1. Võ Thị Bạch Huệ, Vĩnh Định, Hóa phân tích, tập 2, 2008, Nhà xuất bản Y học,
trang 38-57
2. A. P. Kreskov, cơ sở hoá học phân tích, tập 2, (Từ vọng nghi, Trần tứ Hiếu
dịch), 1990, Nhà xuất bản Đại học và Giáo dục chuyên nghiệp, trang 363-376
3. Trần Tử An, Hóa phân tích, tập 2, Nhà xuất bản y học, 2012, trang 264-294

3Phương pháp Volt – Ampe
3

4PHƯƠNG PHÁP CỰC PHỔ CỔ ĐIỂN
4
http://www.librosmaravillosos.com/elmundosintetico/capitulo04.html
Jaroslav Heyrovský bên cạnh phát minh máy cực phổ hiện đại mà ông
đã được nhận giải Nobel. Bên trái là máy cực phổ đầu tiên của ông
5
5
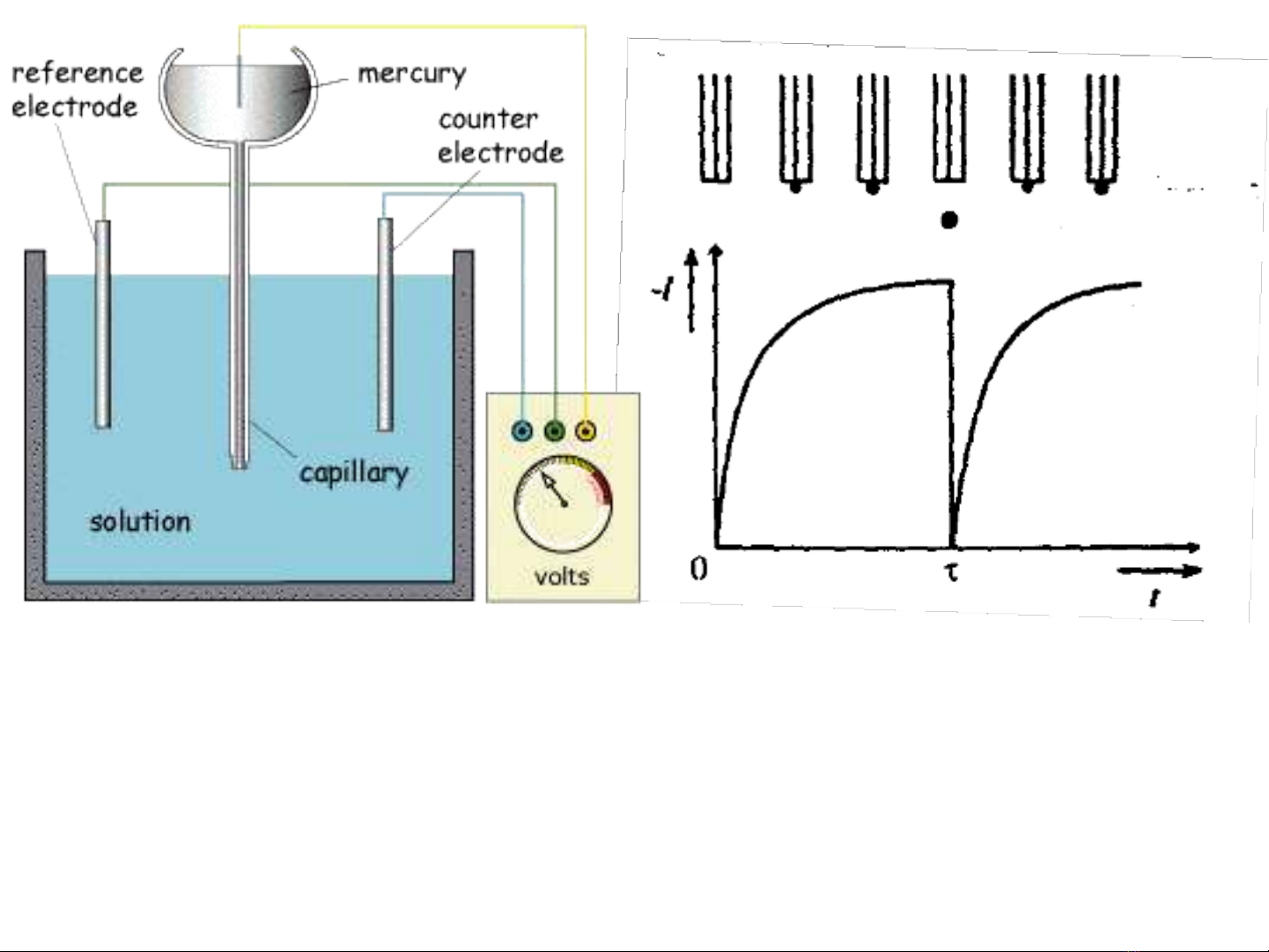
Dòng id của 1 chu kỳ khử Cd+2
Trên cực phổ đồ dòng dòng khuếch tán bị ngắt quãng khi giọt Hg roi xuống
http://www.ceb.cam.ac.uk/research/groups/rg-eme/teaching-notes/hydrodynamic-voltammetry





![Bài giảng Truyền nhiệt [năm] chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2017/20170821/kloiroong10/135x160/4471503277987.jpg)
![Bài giảng Khí lý tưởng Lê Quang Nguyên [PDF]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20160115/doinhugiobay_11/135x160/3731452833386.jpg)



![Động lực học chất lỏng lý tưởng: Chương 4 [Chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2015/20150907/minhnhut1411995/135x160/1773168_156.jpg)
![Đề thi học kì 1 Vật lý lớp 1 năm 2025-2026 (Đề số 2) [Có đáp án]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260210/hoahongcam0906/135x160/1981770793442.jpg)



![Đề thi học kỳ III Vật lý 1 năm 2024-2025 có đáp án [FULL]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260209/diegomaradona04/135x160/99561770719042.jpg)
![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)









