CHƯƠNG 2
CÁC KHÁI NIỆM VÀ
ĐỊNH LUẬT CƠ BẢN
Chương 2
2.1 Đng l ngươ ượ
2.2 Dung d ch–n ng đ dung d chị ồ ộ ị
2.3 Cân b ng hóa h c-Đnh lu t ằ ọ ị ậ
tác d ng kh i l ngụ ố ượ
2.4 Đnh lu t tác d ng đng ị ậ ụ ươ
l ngượ
CHƯƠNG
2
CÁC KHÁI NIỆM&ĐỊNH LUẬT CƠ
BẢN
Chương 2
2.1 Đng l ngươ ượ
CHƯƠNG
2
KHÁI NIỆM&ĐỊNH LUẬT CƠ
BẢN
– Đnh nghĩa ị
– Đng l ng c a nguyên t Xươ ượ ủ ố
– Đng l ng c a h p ch t ABươ ượ ủ ợ ấ
Chương 2
ĐỊNH NGHĨA ĐƯƠNG LƯỢNG
Đương lượng cu$a mô(t nguyên tô, hay mô(t hơ(p
châ,t la0 sô, phâ0n khô,i lươ(ng cu$a nguyên tô, hay
hơ(p châ,t kê,t hơ(p hay thay thê, vư0a đu$ vơ,i:
Mô(t đơn vi(
đương lươ(ng
1,008 phâ0n khô,i lươ(ng cu$a H2
hay 8 phâ0n khô,i lươ(ng cu$a O2
Mô(t đương lươ(ng cu$a mô(t nguyên tô, hay
hơ(p châ,t kha,c
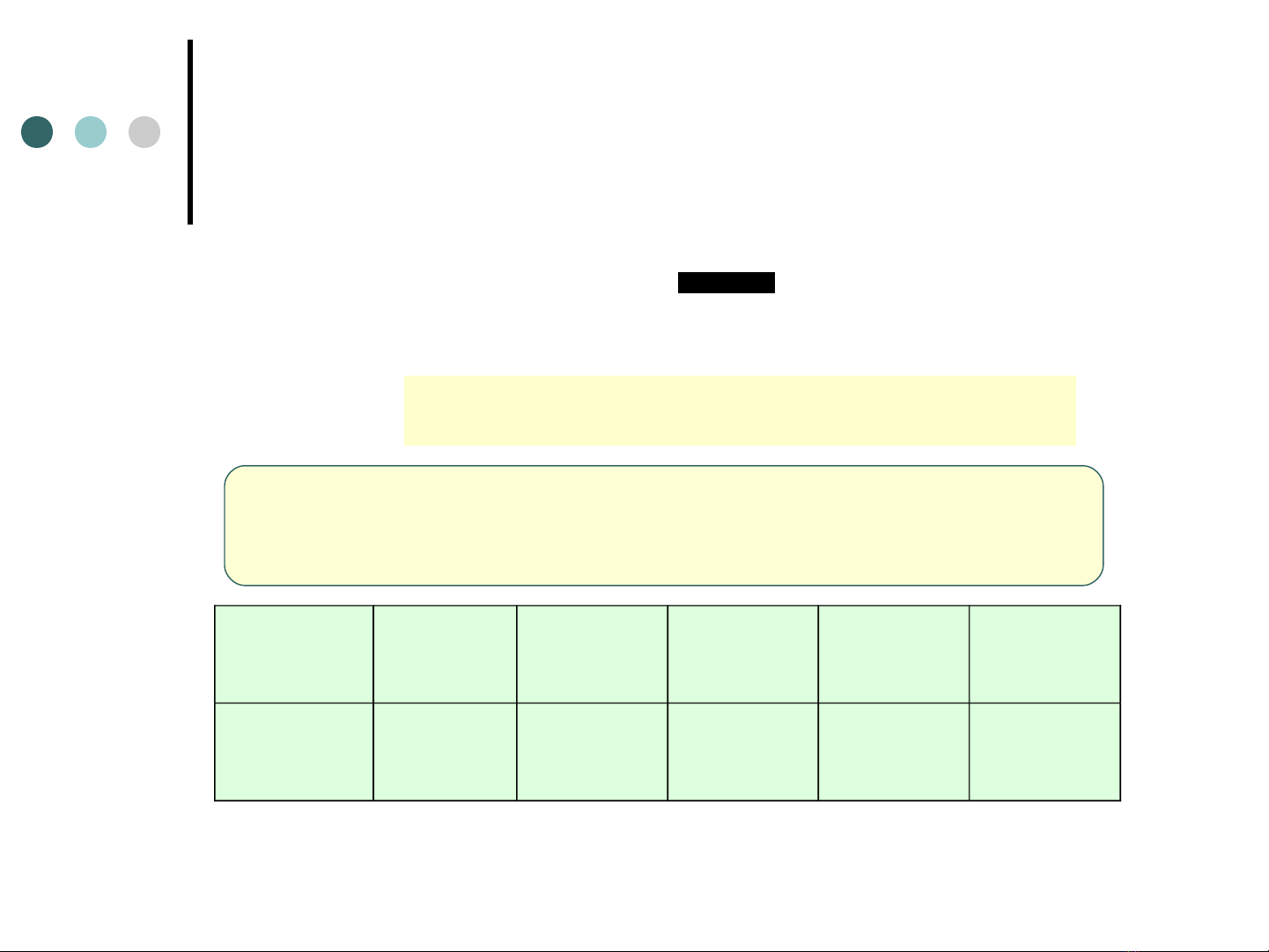
Chương 2
n: ho,a tri( cu$a X trong hơ(p châ,t
Hơ(p
châ,t N2O NO N2O3NO2N2O5
ĐN14 / 1 14 / 2 14 / 3 14 / 4 14 / 5
n
M
Đ
X
X
ĐƯƠNG LƯỢNG CỦA
NGUYÊN TỐ X
Vi, dụ:đương lươ(ng cu$a N trong ca,c hơ(p
châ,t:






![Bài giảng Hóa phân tích TS. Lê Thị Hải Yến: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230607/phuong3129/135x160/2361686125460.jpg)








![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)










