
KHOA HÓA HỌC VÀ CÔNG NGHỆ THỰC PHẨM
ĐẠI HỌC BÀ RỊA – VŨNG TÀU
XÚC TÁC DỊ THỂ
Giảng viên: Diệp Khanh
KHOA HÓA HỌC VÀ CÔNG NGHỆ THỰC PHẨM
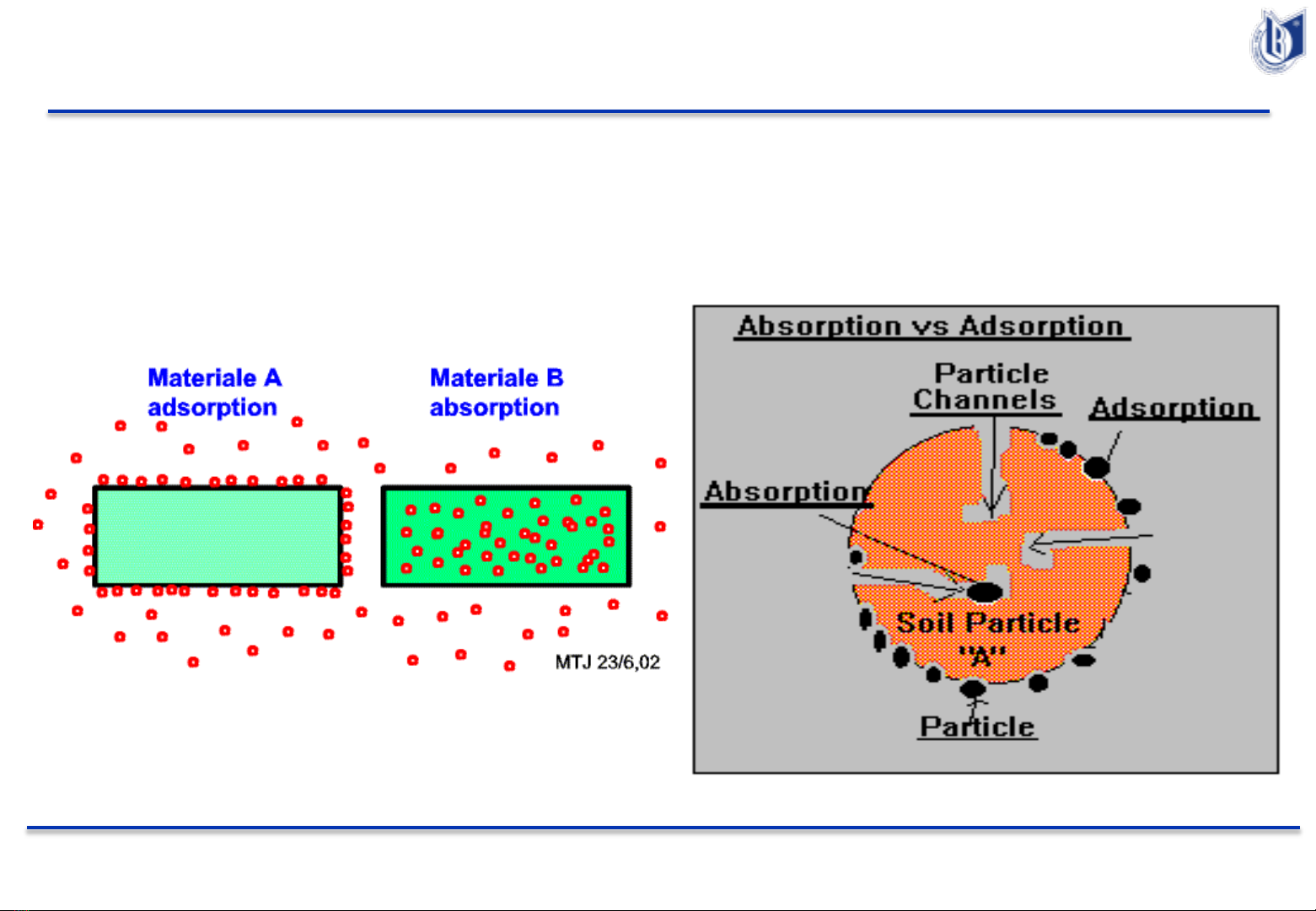
Sự khác nhau giữa Hấp phụ và Hấp thụ
Hấp phụ (Adsorption) và Hấp thụ (Absorption) được gọi
chung là Hấp thu (Sorption).

KHOA HÓA HỌC VÀ CÔNG NGHỆ THỰC PHẨM
3

KHOA HÓA HỌC VÀ CÔNG NGHỆ THỰC PHẨM
Hiện tượng bề mặt - Hấp phụ (Adsorption)
Định nghĩa: Sự hấp phụ là sự tụ tập chất trên bề mặt phân
chia hai pha thể tích (Rắn-Lỏng, Rắn-Khí, Lỏng-Khí)
Chất mà trên bề mặt của nó có sự hấp phụ xảy ra gọi là chất
hấp phụ.
Chất được tụ tập trên bề mặt gọi là chất bị hấp phụ.
Ví dụ:
CO trên Pt
Trang 4

KHOA HÓA HỌC VÀ CÔNG NGHỆ THỰC PHẨM
Bề mặt riêng (của chất hấp phụ): là diện tích bề mặt/1 gam chất
hấp phụ.
-Những chất không có lổ xốp thì có bề mặt riêng từ vài m2/g cho đến vài
trăm m2/g.
-Những chất có hệ thống lỗ xốp và mao mạch phát triển thì bề mặt riêng
có thể lên tới trên 1000 m2/gam
-Ví dụ: Zeolit, than hoạt tính, silicagel,…
Zeolite
Trang 5












![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













