
Bài 1. Một phản ứng bậc 1 đơn giản xảy ra được 30% trong 35 phút. Hãy tính hằng
số tốc độ k. Hỏi sau 5 giờ còn lại bao nhiêu % chất phản ứng.
Tương tự: Một phản ứng bậc 2 đơn giản xảy ra được 30% trong 30 phút. Hãy tính
hằng số tốc độ và sau 1 giờ còn lại bao nhiêu % chất phản ứng.
Giải
Phản ứng bậc 1 : k = 1
𝑡 ln𝐶𝑜
𝐶
Sau 35 phút : k = 1
35 ln 𝐶𝑜
0,7𝐶𝑜 = 0,01 ph-1 ⟹Sau 5 giờ lượng chất phản ứng còn lại : 5%
Phản ứng bậc 2: k = 1
𝑡 (𝐶𝑜−𝐶
𝐶𝑜.𝐶)
Sau 30 phút : k = 1
30 (𝐶𝑜−0,7𝐶𝑜
0,7𝐶𝑜2) = 1
70𝐶𝑜 𝑀−1ph-1 ⟹Sau 1 giờ lượng chất phản ứng còn lại :
53,85%
Bài 2. Một phản ứng phân hủy chất khí có bậc 3/2. Nồng độ đầu của chất phản ứng
là 5,2.10-4 mol/l.
Nếu trong 50 phút phản ứng hết 55% thì hằng số tốc độ (thứ nguyên) bằng bao
nhiêu.
Giải
Ta có: v = −𝑑[𝐴]
𝑑𝑡 = 𝑑𝑥
𝑑𝑡 = k.[𝐴]3
2 ⟺ 𝑑𝑥
(𝑎−𝑥)3/2 = kdt
Lấy tích phân 2 vế ta có : k = 1
0,5𝑡 [ 1
(𝑎−𝑥)0,5−1
𝑎0,5]
Sau 50 phút : k = 1
0,5.50 [ 1
(0,45𝑎)0,5−1
𝑎0,5] với a = 5,2.10-4 M ⟹ k = 0,86 M-0,5ph-1
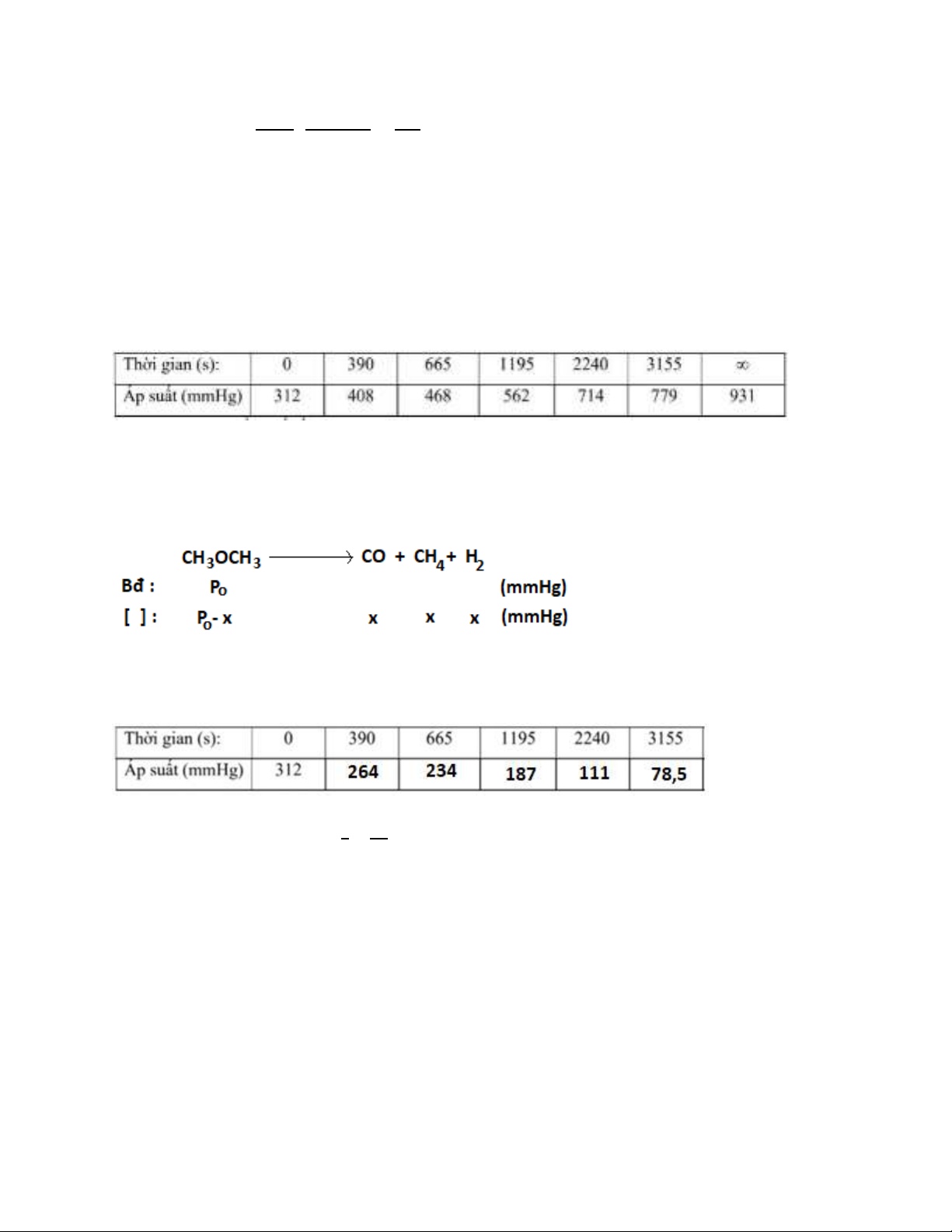
Bài 3. Hơi dimetyleter ở 504oC phân hủy theo phương trình: CH3OCH3 → CH4 + H2
+ CO
Sự phụ thuộc của áp suất chung vào thời gian như sau:
Hãy xác định bậc và hằng số tốc độ.
Giải
Ta có : [Ptổng] = Po + 2x ⟹ 𝑃𝐶𝐻3𝑂𝐶𝐻3 tại các thời điểm khác nhau:
Giả sử phản ứng bậc 1 : k = 1
𝑡 ln𝑃𝑜
𝑃
Tại t1 = 390s ⟹ k1 = 4,283.10-4 s-1
Tại t2 = 665s ⟹ k2 = 4,326.10-4 s-1
Tại t3 = 1195s ⟹ k3 = 4,283.10-4 s-1
Tại t4 = 2240s ⟹ k4 = 4,613.10-4 s-1
Tại t5 = 3155s ⟹ k5 = 4,374.10-4 s-1

Ta có k1 ~ k2 ~ k3 ~ k4 ~ k5 ~ const ⟹ Giả sử đúng vậy bậc của phản ứng phân hủy hơi
dimethylete là bậc 1 ⟹ kpư = ∑𝑘𝑛
5
𝑛=1
5 = 4,376.10-4 s-1
Bài 4. Một phản ứng bậc 1 đã phản ứng được 25% trong 50 phút. Hỏi sau 50 phút
nữa nồng độ của tác chất là bao nhiêu. Biết nồng độ đầu là 5.103 mol.dm-3
Giải
Phản ứng bậc 1 đã phản ứng được 25% trong 50 phút ⟹ Sau 50ph nữa thì lương chất
còn lại là 1 nửa so với ban đầu ⟹ C100ph = 2,5.103 mol.dm-3
Bài 5. Trong phản ứng phân hủy N2O5 thành N2O4 và O2. Biết PN2O5 phụ thuộc vào
thời gian như sau:
Hãy xác định bậc và hằng số tốc độ.
Giải
Giả sử phản ứng bậc 1 : k = 1
𝑡 ln𝑃𝑜
𝑃
Tại t1 = 20s ⟹ k1 = 8,06.10-3 s-1
Tại t2 = 40s ⟹ k2 = 8,03.10-3 s-1
Tại t3 = 60s ⟹ k3 = 8,05.10-3 s-1
Ta có k1 ~ k2 ~ k3 ~ const ⟹ Giả sử đúng vậy bậc của phản ứng phân hủy N2O5 là bậc 1
⟹ kpư = ∑𝑘𝑛
3
𝑛=1
3 = 8,046.10-3 s-1

Bài 6. Phản ứng làm mất màu của một chất dưới tác động của tia tử ngoại được theo
dõi bằng phương pháp trắc quang. Mật độ quang D phụ thuộc vào thời gian như
sau:
Hãy xác định bậc và hằng số tốc độ.
Giải
Giả sử phản ứng bậc 2 : k = 1
𝑡 (𝐷𝑜−𝐷
𝐷𝑜.𝐷)
Tại t1 = 2ph ⟹ k1 = 0,099 µm-1ph-1
Tại t2 = 4ph ⟹ k2 = 0,093 µm-1ph-1
Tại t3 = 7ph ⟹ k3 = 0,098 µm-1ph-1
Tại t4 = 11ph ⟹ k4 = 0,095 µm-1ph-1
Tại t5 = 15ph ⟹ k5 = 0,1 µm-1ph-1
Tại t6 = 20ph ⟹ k6 = 0,12 µm-1ph-1
Ta có k1 ~ k2 ~ k3 ~ k4 ~ k5 ~ k6 ~ const ⟹ Giả sử đúng vậy bậc của phản ứng là bậc 2
⟹ kpư = ∑𝑘𝑛
5
𝑛=1
5 = 0,1 µm-1ph-1
Bài 7. Trong môi trường acid, đường saccaroz thủy phân theo phản ứng bậc 1 thành
glucoze và fructose theo phương trình: C12H22O11 + H2O → C6H12O6 + C6H12O6.
Đường saccaroze quay cực về phía phải, còn sản phẩm quay cực về phía trái. Người
ta đo độ quay cực chung α vào thời gian như sau.

a. Xác định hằng số tốc độ phản ứng.
b. Bao nhiêu % saccaroze bị thủy phân sau 236 phút.
a) Giải
Hằng số tốc độ phản ứng k = 1
176 ln −8,38−25,16
−8,38−5,46 = 5,03.10-3 ph-1
b) Sau 236ph % saccarose bị thủy phân : 69,5%
Bài 8. Trộn 2 chất A và B có cùng thể tích và nồng độ. Phản ứng xảy ra theo phương
trình:
A + B → C. Sau 1 giờ A phản ứng hết 75%. Hỏi sau 2 giờ A còn lại bao nhiêu, nếu
phản ứng là:
a. Bậc 1 theo A và bậc 0 theo B
b. Bậc 1 theo mỗi cấu tử.











![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














