Trang 1/2 - Mã đề 391
SỞ GIÁO DỤC VÀ ĐÀO TẠO
THÀNH PHỐ HỒ CHÍ MINH
TRƯỜNG THPT GIA ĐỊNH
KIỂM TRA ĐÁNH GIÁ CUỐI KÌ I (NĂM HỌC: 2022 – 2023)
Môn: HÓA HỌC – Khối: 10
Thời gian làm bài: 45 phút, không kể thời gian phát đề
ĐỀ CHÍNH THỨC
(Đề có 02 trang)
A - TRẮC NGHIỆM (4,0 điểm): Học sinh trả lời trên phiếu trả lời trắc nghiệm
Câu 1: Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch
dẫn điện được. Hợp chất A là
A. sodium chloride (NaCl). B. glucose (C6H12O6).
C. sucrose (C12H22O11). D. fructose (C6H12O6).
Câu 2: Năng lượng của một liên kết hóa học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí. Giá
trị năng lượng của một liên kết hóa học là thước đo độ bền liên kết. Cho năng lượng liên kết của các phân tử
được liệt kê trong bảng sau
Liên kết
Năng lượng liên kết (kJ/mol)
Cl–Cl
242
Br–Br
192
I–I
150
Hãy chọn phương án đúng khi so sánh độ bền liên kết giữa Cl2, Br2 và I2.
A. Cl2 > I2 > Br2. B. I2 > Br2 > Cl2.
C. Br2 > Cl2 > I2. D. Cl2 > Br2 > I2.
Câu 3: Các nguyên tố ở chu kì 4 có số lớp electron trong nguyên tử là bao nhiêu?
A. 5. B. 3. C. 2. D. 4.
Câu 4: Hợp chất CaF2 được tạo thành từ lực hút tĩnh điện của các ion nào sau đây?
A. Ca+, F–. B. Ca2+, F– C. Ca+, F2–. D. Ca2+, F2–.
Câu 5: Chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2. B. N2. C. HCl. D. O2.
Câu 6: Đại lượng nào sau đây trong nguyên tử của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện
tích hạt nhân nguyên tử?
A. Số electron ở lớp ngoài cùng. B. Nguyên tử khối.
C. Số lớp electron. D. Số electron trong nguyên tử.
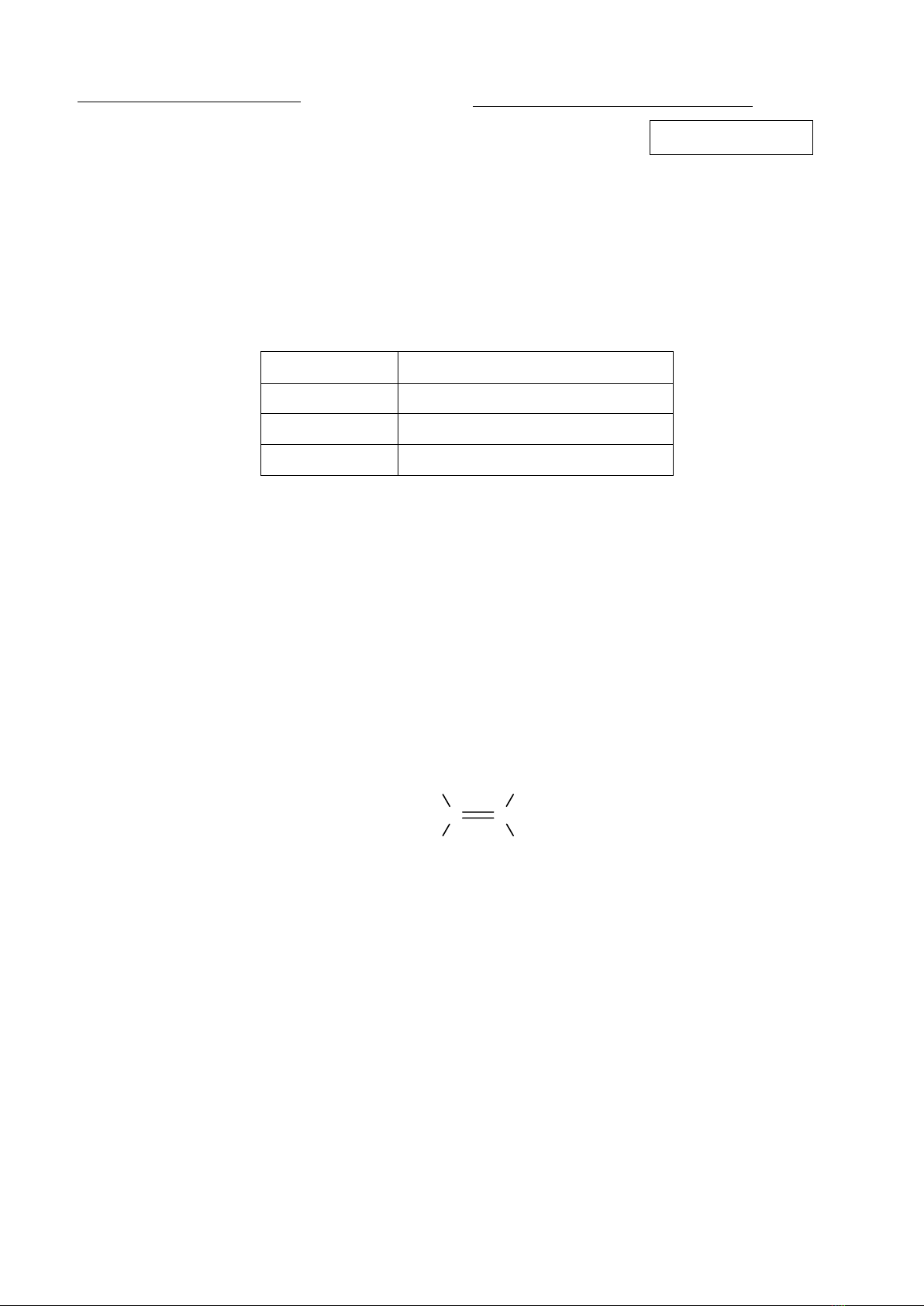
Câu 7: Cho ethylene có công thức cấu tạo như sau:
C C
H
H H
H
Số liên kết π và số liên kết σ trong phân tử ethylene lần lượt là
A. 1; 5. B. 2; 4. C. 1; 4. D. 2; 3.
Câu 8: Theo quy tắc octet, khi hình thành liên kết hoá học, các nguyên tố có xu hướng nhường, nhận hoặc
góp chung electron để đạt tới cấu hình electron bền vững giống như
A. kim loại kiềm thổ gần kề. B. kim loại kiềm gần kề.
C. nguyên tử khí hiếm gần kề. D. nguyên tử halogen gần kề.
Câu 9: Liên kết ion có bản chất là
A. Sự dùng chung các electron.
B. Lực hút tĩnh điện của các ion mang điện tích trái dấu.
C. Lực hút tĩnh điện giữa cation kim loại với các electron tự do.
D. Lực hút giữa các phân tử
Câu 10: Hợp chất khí với hydrogen của nguyên tố M là RH3. Công thức oxide cao nhất của R là
A. R2O3. B. R2O5. C. R2O. D. RO3.
Câu 11: Cho các nguyên tố: N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo
chiều giảm dần bán kính nguyên tử từ trái sang phải là
A. Mg, N, Si. B. Mg, Si, N. C. N, Mg, Si. D. N, Si, Mg.
Câu 12: Độ âm điện đặc trưng cho khả năng
A. hút electron của nguyên tử trong phân tử.
MÃ ĐỀ: 391

Trang 2/2 - Mã đề 391
B. tham gia phản ứng mạnh hay yếu.
C. nhường electron của nguyên tử này cho nguyên tử khác.
D. nhường proton của nguyên tử này cho nguyên tử khác.
Câu 13: Trong phân tử khí nitrogen (N2), số cặp electron chung giữa hai nguyên tử nitrogen là
A. 2. B. 1. C. 3. D. 4.
Câu 14: Nguyên tử X có 9 electron. Ion được tạo thành từ X theo quy tắc octet có số electron là
A. 12 electron. B. 8 electron. C. 9 electron. D. 10 electron.
Câu 15: Số nhóm A trong bảng tuần hoàn là
A. 18. B. 14. C. 8. D. 6.
Câu 16: Ion nào sau đây là cation?
A. S2-. B. Br-. C. O2-. D. Na+.
B – TỰ LUẬN (6,0 điểm) Học sinh trình bày vào giấy làm bài tự luận
PHẦN CHUNG CHO TẤT CẢ CÁC HỌC SINH (5,0 điểm)
Câu 1: (1,0 điểm) Nguyên tố phosphorus (P) rất cần cho người và động vật. Trong cơ thể người, khoảng 90%
phosphorus tập trung ở xương, khoảng 10% tập trung ở các cơ, gần 1% ở các tế bào não (dưới dạng các hợp
chất vô cơ và hữu cơ). Ở các cơ, gan, não và các bộ phận khác của cơ thể, phosphorus có dưới dạng các
phosphate và các ester của phosphoric acid. Phosphorus có cấu hình electron ngoài cùng là 3p3.
Hãy viết cấu hình electron của phosphorus và xác định vị trí của phosphorus trong bảng tuần hoàn (không cần
giải thích)
Câu 2: (2,0 điểm)
a. Viết công thức công thức cấu tạo, công thức Lewis của các phân tử sau: Cl2, NH3.
b. Dựa vào độ âm điện của các nguyên tố, xác định kiểu liên kết (liên kết ion, liên kết cộng hóa trị phân cực
hay liên kết cộng hóa trị không phân cực) trong phân tử các hợp chất sau: CH4, Cl2O, NaCl, CO2.
Cho độ âm điện của các nguyên tố:
Nguyên tố
Na
H
C
Cl
O
Độ âm điện
0,93
2,20
2,55
3,16
3,44
Câu 3: (1,0 điểm) Oxide cao nhất của một nguyên tố R là RO2, chất được thu hồi từ quá trình chuyển hóa khí
thiên nhiên, các sản phẩm của dầu mỏ, RO2 là một chất làm lạnh quan trọng, chúng tham gia vào quá trình lưu
trữ và vận chuyển các loại kem và các thực phẩm đông lạnh. Trong hợp chất khí với hydrogen của nguyên tố
R có 25% hydrogen về khối lượng. Hãy xác định tên của nguyên tố R?
Câu 4: (1,0 điểm) Hòa tan hết 7,6 gam hai kim loại X, Y thuộc hai chu kỳ liên tiếp của nhóm IIA vào nước
dư thì thu được 0,5 gam khí. Xác định tên của hai kim loại X, Y và tính khối lượng của mỗi kim loại trong
hỗn hợp ban đầu.
PHẦN RIÊNG A (1,0 điểm) (dành cho các lớp 10CT, 10CL, 10CTin, 10T, 10HS1, 10HS2, 10TN1,
10TN2, 10TN3, 10TN4, 10TN5, 10TN6)
Câu 5A: Đốt cháy hoàn toàn hỗn hợp Z gồm Cu và Mg với khí oxygen ở nhiệt độ cao, thu được hỗn hợp gồm
các oxide. Cho lượng oxide này tác dụng vừa đủ với dung dịch hydrochlodric acid HCl 14,6% thu được dung
dịch T. Dung dịch T có nồng độ phần trăm của CuCl2 là 8,13%. Tính nồng độ phần trăm của MgCl2 trong
dung dịch T?
PHẦN RIÊNG B (1,0 điểm) (dành cho các lớp 10L, 10H)
Câu 5B: Cho 7,65 gam BaO vào 100 gam dung dịch H2SO4 3,92 % thu được kết tủa trắng BaSO4 và dung
dịch A. Tìm nồng độ phần trăm của dung dịch A.
PHẦN RIÊNG C (1,0 điểm) (dành cho lớp 10CH)
Câu 5C:
Muối fluoride của kim loại barium có cấu trúc mạng lập phương như hình bên, có
khối lượng riêng là 4,89 g/cm3.
a. Trong một ô mạng cơ sở có bao nhiêu phân tử BaF2?
b. Tính cạnh a của ô mạng cơ sở BaF2 theo nm.
Cho khối lượng mol: Ba = 137,327; F = 18,998.
Cho nguyên tử khối của các nguyên tố:
H = 1; C = 12; O = 16; Si = 28; S = 32; Cl = 35,5; Cu = 64
Be = 9; Mg = 24; Ca = 40; Sr = 87,5; Ba = 137
Học sinh không dùng bảng tuần hoàn các nguyên tố hóa học.
-------Hết-------












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



