
73
nghiệp, ngọn lửa được truyền trong các điều kiện xoáy lốc mạnh yếu khác nhau và việc
khống chế các điều kiện này là một yếu tố quan trọng trong tối ưu hoá sự cháy.
Bảng 29.
Những dạng thức khác nhau về sự cháy
Vùng không gian tồn tại các điều kiện áp suất, nhiệt
độ, thành phần
Hiện tượng truyền nhiệt
và truyền khối
Siêu hạn Dưới giới hạn Kiểu phẳng Kiểu rối
Các chất phản
ứng trong hỗn
hợp trộn đều lí
tưởng
Tự bốc cháy (hay nổ
theo nghĩa nghiêm
ngặt).
Sự châm lửa = sự tự
bốc cháy tiếp theo sự
truyền cháy
Sự truyền cháy bị khống chế
bởi:
- Khuếch tán các chất tham gia
phản ứng và độ dẫn nhiệt.
- Các hiện tượng khác mà
chúng quyết định các điều kiện
tới hạn như sóng va chạm.
Sự bùng nổ
phẳng
Sự bùng nổ
rối
Các chất phản
ứng không
được trộn trước
Sự truyền bị khống chế bởi sự
hoá hơi, khuếch tán nội của
các chất tham gia phản ứng
Ngọn lửa
khuếch tán
phẳng
Ngọn lửa
khuếch tán
rối
Các hiện tượng mà chúng ta vừa nêu ra ở trên (sự tự bốc cháy, sự bùng nổ trong hỗn
hợp sơ bộ, ngọn lửa khuếch tán, ngọn lửa phẳng, ngọn lửa rối, sự nổ, ...) được trình bày
tóm tắt ở bảng 29 và chúng xảy ra trong các điều kiện hoàn toàn đoạn nhiệt. Trong những
trường hợp thực tế, sự giam hãm các chất tham gia phản ứng dẫn tới mất nhiệt và các gốc
tự do khi đó người ta gọi là ngọn lửa bị giam hãm hay không đoạn nhiệt. ảnh hưởng của sự
giam hãm có thể đóng một vai trò quan trọng lên trạng thái cuối cùng của sự cháy và lên
tốc độ truyền của ngọn lửa và trong các trường hợp giới hạn nó có thể làm cho sự cháy
không xảy ra. Bởi vậy, sự giam hãm từ phía bên ngoài, đặt ra các giới hạn cho sự tồn tại
của ngọn lửa và người ta gọi các giới hạn này là các giới hạn ngoại lai.
Trong đại đa số các áp dụng công nghiệp (động cơ, lò đốt, tuabin), ảnh hưởng của
thành thiết bị đóng một vai trò không thuận lợi và người ta cố gắng làm giảm tối thiểu nó.
Ví dụ đối với các động cơ đốt trong mà ở đó sự tắt ngọn lửa ở ngay đầu xilanh có thể là
nguồn gốc của các hiđrocacbon không cháy hết bị thải ra ngoài, ngay trong các điều kiện
làm việc lí tưởng. Nhưng ngược lại, trong các trường hợp khác người ta lại lợi dụng các
ảnh hưởng của thành thiết bị. Như trong lĩnh vực an toàn, để cản trở sự truyền lửa, người ta
sử dụng những thiết bị dựa trên cơ sở cản trở ngọn lửa bằng cách cho qua giữa các thành
đủ gần nhau: đó là sự ngừng cháy.
Bên cạnh các giới hạn ngoại lai do sự nhốt các thành phần hỗn hợp cháy còn có các
giới hạn về khả năng truyền lửa nội bắt nguồn từ bản chất của hỗn hợp “nhiên liệu - chất
duy trì tự cháy”. Đó là các giới hạn có thể cháy, giới hạn có thể nổ. Các giới hạn này phụ
thuộc vào thành phần của hỗn hợp và vào mức độ pha loãng bởi khí trơ.
Trong đại đa số các trường hợp, các phản ứng cháy được thực hiện ở pha khí. Ngay sự
cháy của một số nhiên liệu như gỗ, sáp, than béo, thì trước tiên đó là ngọn lửa khuếch tán
trong pha khí. Thật vậy, do nhiệt phân hủy hay chưng cất, các hơi của nhiên liệu thoát ra

74
khỏi các vật thể này và cháy sau khi trộn với oxi của không khí. Song sự cháy cũng có thể
định xứ ở pha lỏng hay rắn. Ví dụ đó là sự nổ của các thuốc nổ rắn hay lỏng như nitro
glyxerin.
5.2 Nhiệt động học và động học của sự cháy
Cháy nhanh là một dãy các phản ứng hóa học cơ bản có kiểu rất đặc biệt. Vì thế cần
nhắc lại những cơ sở nhiệt động học và động học của nó. Trong đại đa số các trường hợp,
những ứng dụng của sự cháy hướng vào chuyển hoá năng lượng hóa học của nhiên liệu
thành nhiệt. Có thể nhiệt này sẽ trải qua một sự biến đổi tiếp theo thành những dạng năng
lượng khác. Lượng năng lượng hóa học bị chuyển hoá thành bức xạ ánh sáng nhìn thấy là
tương đối thấp. Lượng nhiệt năng được giải phóng bởi sự đốt nóng có thể tính toán được từ
các dữ kiện nhiệt động học. Song điều quan trọng là phải biết tốc độ và cơ chế phản ứng
cho phép người ta hiểu được và có thể điều khiển được quá trình cháy. Điều này rất quan
trọng để tính toán lò phản ứng hóa học.
5.2.1 Cơ sở nhiệt động học của sự cháy
Cháy là phản ứng oxi hoá của chất khử (được gọi là nhiên liệu) với một chất oxi hoá
được gọi là chất duy trì sự cháy (hay chất gây cháy, chất oxi hoá nhiên liệu).
Trong đại đa số các trường hợp, chất duy trì sự cháy là oxi từ không khí, các hợp chất
hóa học khác nhau, các oxit cao của nitơ, clo hay flo đóng vai trò chất oxi hoá trong các
phản ứng dạng đặc biệt.
Các nhiên liệu phổ biến nhất là hợp chất hữu cơ trong đó các hiđrocacbon chiếm vị trí
lớn nhất. Các sản phẩm của phản ứng này cơ bản là khí CO2 và hơi nước.
Ví dụ: propan cháy với một lượng hợp thức không khí thì phản ứng tổng cộng có thể
viết theo cách sau:
C3H8 + 5O2 + 18,8N2 → 3CO2 + 4H2O + 18,8N2 + Q (1a)
Hay một cách chung nhất đối với một hiđrocacbon CnHm bất kì:
CnHm + m
n4
⎛⎞
+
⎜⎟
⎝⎠
(O2 + 3,76 N2) → nCO2 + m
2H2O + 3,76 m
n4
⎛⎞
+
⎜⎟
⎝⎠
N2 + Q (1b)
Trong các phương trình này, Q là lượng nhiệt được giải phóng bởi một mol nhiên liệu
bị cháy và được gọi là nhiệt đốt cháy. Nó bằng hiệu số giữa tổng các nhiệt hình thành các
chất phản ứng và nhiệt hình thành các sản phẩm. Giá trị Q phụ thuộc vào bản chất của
nhiên liệu và chất duy trì sự cháy. Bảng 30 cho nhiệt đốt cháy của một số nhiên liệu với
oxi.
Bảng 30.
Nhiệt đốt cháy của một số nhiên liệu
(ở 25°C, các sản phẩm cháy là CO2, H2O (hơi),
tất cả các nhiên liệu nằm ở trạng thái hơi hay khí)

75
Nhiên liệu Nhiệt đốt cháy
(cal/mol nhiêu liệu)
Cacbon (rắn) 94.052
Hiđro 57.797
Metan 191.766
Etan 341.260
Propan 488.530
n-Butan 635.050
iso-Butan 635.050
n-heptan 1075.850
Etilen 316.200
Propilen 400.430
Axetilen 300.000
Benzen 757.520
Toluen (metylbenzen) 749.420
Etylbenzen 1048.530
Stiren 1018.830
Oxit cacbon 67.637
Trong cháy đoạn nhiệt, toàn bộ năng lượng được giải phóng được tích luỹ trong sản
phẩm cháy:
Q =
f
i
T
P
T
CdT
∫
(2)
trong đó Ti, Tf là nhiệt độ ban đầu của nhiên liệu và nhiệt độ cháy. CP nhiệt dung riêng của
sản phẩm cháy theo mol.
Biểu thức này chỉ ra rằng nhiệt đốt cháy đoạn nhiệt được tính từ nhiệt độ ban đầu Ti
đến nhiệt độ Tf nằm giữa 2000 và 3000K. ở những nhiệt độ tương đối cao này, khí CO2 và
hơi nước bị phân ly một phần theo các cân bằng sau đây:
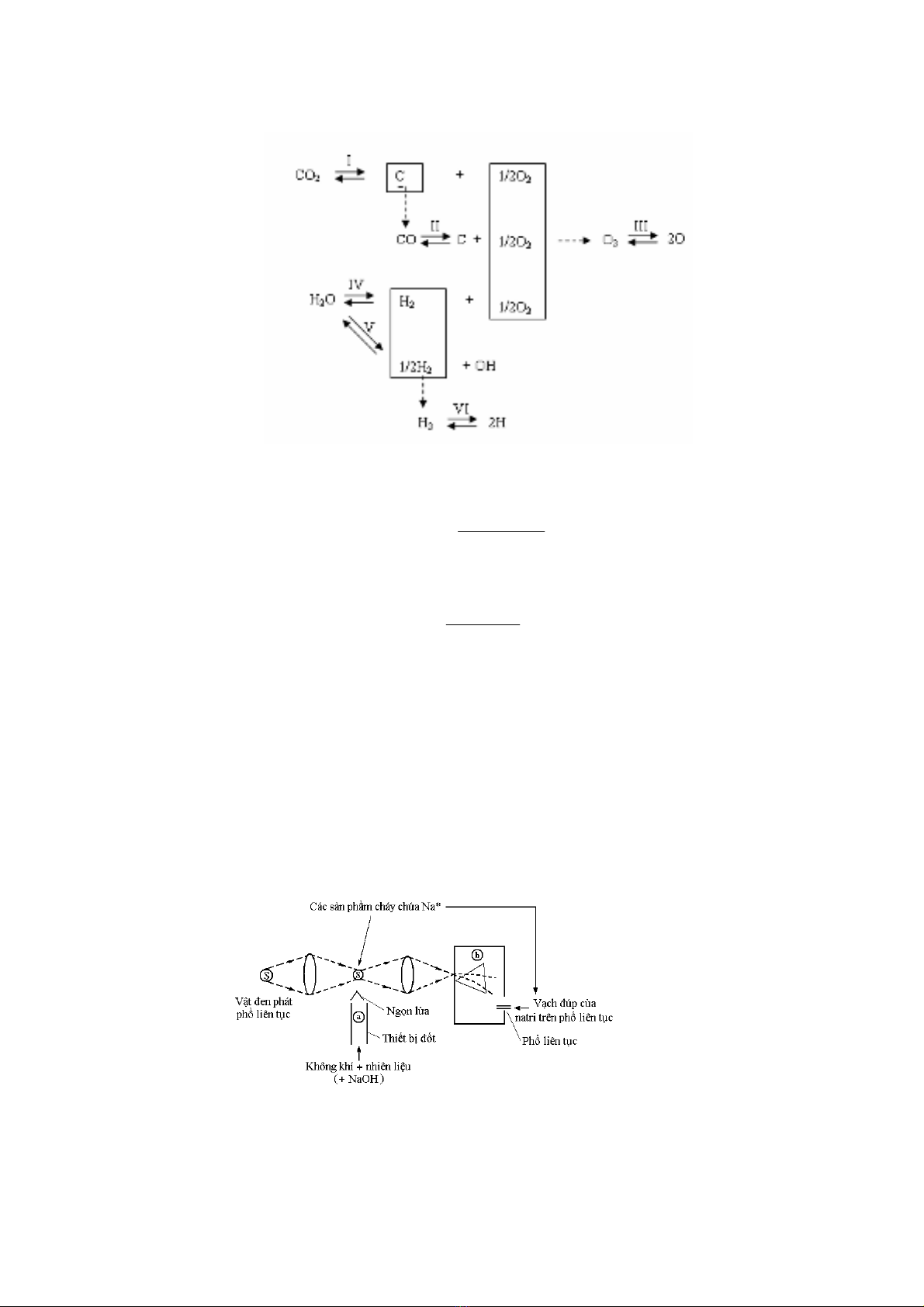
76
Các cân bằng từ I đến VI có thể được đặc trưng bằng các hằng số cân bằng của các
quá trình hóa học, như vậy hằng số phân ly của cân bằng I được viết:
KI =
1/2
2
2
[CO][O ]
[CO ]
Và hằng số cân bằng II là:
KII =
1/2
2
[C][O ]
[CO] v.v...
Các hằng số này phụ thuộc vào nhiệt độ và áp suất. Sự biến đổi theo nhiệt độ của
chúng cần phải biết để tính toán nhiệt độ cân bằng (Tf) và các nồng độ ở cân bằng của các
khí CO2, CO, hơi nước và các sản phẩm phân ly của chúng. Việc biết chính xác nhiệt độ
cân bằng của các sản phẩm cháy có một tầm quan trọng lớn đối với các ứng dụng công
nghiệp. Nhiệt độ cân bằng quyết định không những chỉ hiệu năng của động cơ mà còn cố
định được ứng suất nhiệt của nhiên liệu. Ví dụ, trong trường hợp của các cánh tuabin khí
nhiệt độ cân bằng đóng vai trò quan trọng hàng đầu.
Một trong những phương pháp thông dụng nhất được dùng để đo nhiệt độ ngọn lửa là
phương pháp nghịch đảo vạch. Hình 11 trình bày sơ đồ nguyên lí đo nhiệt độ ngọn lửa theo
phương pháp này.
Hình 11.
Sơ đồ đo nhiệt độ cháy (Tf) theo phương pháp đảo ngược vạch của natri
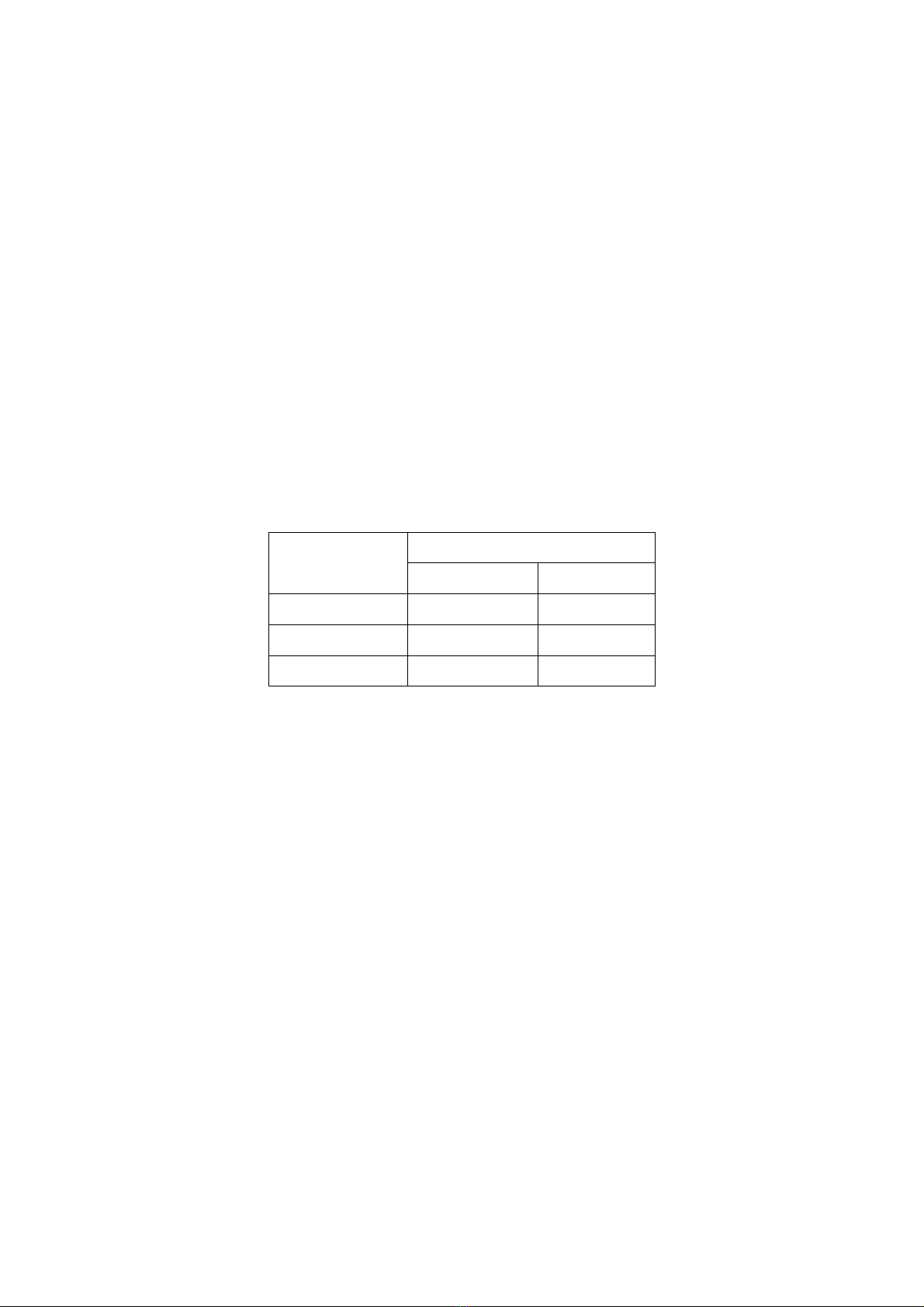
77
Giả sử rằng ta phải xác định nhiệt độ cháy của một ngọn lửa được tạo ra khi cháy mà
nhiên liệu và chất duy trì sự cháy đã được trộn kĩ trước. Ngọn lửa đã được ổn định ở đầu
của một thiết bị đốt hình trụ (a). Bằng một phương pháp thích hợp, người ta đưa những
lượng vết rất nhỏ hợp chất của natri (ví dụ NaOH) vào trong dòng khí cung cấp cho thiết bị
đốt. Cùng với các sản phẩm cháy, natri được đốt nóng lên đến nhiệt độ của các sản phẩm
cháy và nó phát ra hai vạch cộng hưởng với độ dài sóng là 5890 và 5896Å. Với sự trợ giúp
của máy quang phổ b, người ta quan sát phổ của sản phẩm cháy phát ra từ ngọn đèn (S)
chồng với phổ liên tục phát ra từ vật đen S’. Như vậy người ta quan sát thấy phổ liên tục
của vật đen mà trên đó vạch đúp của natri hoặc là được phát ra hoặc là bị hấp thụ. Khi các
vạch của natri được quan sát thấy trên phổ liên tục, thì nhiệt độ của ngọn lửa là cao hơn
nhiệt độ của vật đen; còn khi các vạch này bị hấp thụ thì nhiệt độ của ngọn lửa thấp hơn
nhiệt độ của vật đen. Khi nhiệt độ của vật đen và ngọn lửa bằng nhau thì hai vạch trên
không xuất hiện trong phổ hấp thụ cũng như phát xạ. Sự bằng nhau về nhiệt độ này được
điều chỉnh bằng dòng đốt dây vonfram ở nguồn S’. Dòng đốt này đã được chuẩn hoá trước,
từ đó người ta có thể đọc được nhiệt độ tương ứng với mỗi một cường độ dòng đốt. Nói
chung, các giá trị nhiệt độ tính toán được là cao hơn các giá trị thực nghiệm (xem bảng 31).
Bảng 31.
Giá trị nhiệt độ ngọn lửa của hỗn hợp hợp thức CH4/O2
được pha loãng bằng N2 (nhiệt độ ban đầu của hỗn hợp 295K, áp suất khí quyển)
Nhiệt độ ngọn lửa, Tf (K)
Nitơ trong hỗn hợp
(%) Đo được Tính toán được
52,5 2570 2677
60 2450 2552
70 2145 2285
Sự khác nhau về Tf có thể được giải thích bởi thực tế là sự cháy không bao giờ xảy ra
hoàn toàn đoạn nhiệt nghĩa là luôn luôn có sự mất nhiệt do sự dẫn nhiệt và bức xạ nhiệt mà
khi tính toán không kể tới. Ngoài ra, cần phải chú ý rằng ngay ở vùng cháy, nhiệt độ của
các sản phẩm cháy vẫn không nằm trong cân bằng nhiệt động học lí tưởng.
Ở nhiệt độ và áp suất ban đầu đã cho, giá trị của nhiệt độ ngọn lửa phụ thuộc vào
thành phần của hỗn hợp; tuỳ thuộc vào thành phần của hỗn hợp, nhiệt độ đạt đến một cực
đại ở gần những giá trị hợp thức (hình 12). Sự pha loãng hỗn hợp có thể bốc cháy đã làm
giảm nhiệt độ ngọn lửa bởi vì khí trơ hấp thụ một phần nhiệt đốt cháy (ở đây khí trơ là N2
và tỉ lệ nitơ tăng dần từ hỗn hợp 1 đến 8).
Khi người ta tăng nhiệt độ ban đầu hay áp suất ban đầu của hỗn hợp có thể cháy thì
nhiệt độ cháy cuối cùng cũng tăng lên. Hiệu ứng của áp suất và nhiệt độ ban đầu này được
minh hoạ trên hình 13 và được giải thích bởi thực tế 2 thông số này có khuynh hướng làm
giảm mức độ phân ly của sản phẩm cháy.















![Quy hoạch tổng thể Cà Mau: Tài liệu [mới nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250827/tghong1621@gmail.com/135x160/49401756278390.jpg)


![Bài giảng Hàng hải địa văn [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250729/vijiraiya/135x160/43361753782101.jpg)
![Bài giảng Trắc địa cơ sở [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250729/vijiraiya/135x160/84_bai-giang-trac-dia-co-so.jpg)





![Atlas tài nguyên nước Việt Nam: Tài liệu [Mô tả/Hướng dẫn/Chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250715/vijiraiya/135x160/348_tai-lieu-atlas-tai-nguyen-nuoc-viet-nam.jpg)
